Cornforth-Umlagerung
Die Cornforth-Umlagerung ist eine Namensreaktion der organischen Chemie und wurde 1949 von dem australischen Chemiker John W. Cornforth entdeckt.[1] Dabei handelt es sich um die thermische Umlagerung von carbonylsubstituierten 1,3-Oxazolen zu isomeren 1,3-Oxazolen.[2]
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]In der Originalarbeit verwendete John W. Cornforth 2-Phenyl-5-ethoxyoxazol-4-carboxamid (R1= Phenylgruppe R2= Ethoxygruppe R3= Aminogruppe).[1]
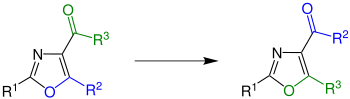
Die Reaktion läuft jedoch auch mit einer Vielzahl anderer carbonylsubstituierter 1,3-Oxazolen ab.[2]
In den frühen 1970er-Jahren wurde die Reaktion von Michael Dewar weiter erforscht. Es stellte sich heraus, dass die Reaktion bei der Verwendung von stickstoffhaltigen Heterocyclen (R3= N-Heterozyklus) besonders gute Ausbeuten von mehr als 90 % erzielt.[2][3]
Mechanismus
[Bearbeiten | Quelltext bearbeiten]Hauptschritt des Mechanismus ist eine pericyclische Ringöffnung mit anschließender Umlagerung.[4]

Wird das eingesetzte 1,3-Oxazol erhitzt bildet sich durch eine Ringöffnung das Dicarbonylnitril 1. Dieses Zwischenprodukt kann nicht isoliert werden. Im Anschluss greift das Sauerstoffatom an dem Kohlenstoffatom der Nitrilgruppe an und vollzieht einen erneuten Ringschluss.
Ob die Reaktion überhaupt abläuft hängt von der Energiedifferenz von Edukt und Produkt ab.

Maßgeblich entscheidend für diese sind die Substituenten R2 und R3, diese beeinflussen die dargestellte Isomerisierung des Zwitterions.[2]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Die Cornforth-Umlagerung findet Anwendung in der Synthese von Aminosäuren. Hier treten die entsprechenden Oxazole als Zwischenprodukte auf.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b J. W. Cornforth, E. Fawaz, L. J. Goldsworthy, Robert Robinson: 330. A synthesis of acylamidomalondialdehydes. In: Journal of the Chemical Society (Resumed). 1949, S. 1549–1553, doi:10.1039/JR9490001549.
- ↑ a b c d e László Kürti, Barbara Czakó: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms. Elsevier Academic Press, 2005, ISBN 978-0-12-429785-2, S. 112–113.
- ↑ Michael J. S. Dewar: Cornforth rearrangement. In: Journal of the American Chemical Society. Band 96, Nr. 19, September 1974, S. 6148–6152, doi:10.1021/ja00826a030.
- ↑ Jie Jack Li: Name Reactions – A Collection of Detailed Reaction Mechanisms. Springer, 2006, ISBN 978-3-540-30030-4, S. 95.