Dowd-Beckwith-Ringerweiterung
Die Dowd-Beckwith-Ringerweiterung ist eine Namensreaktion in der organischen Chemie. Die Erstveröffentlichung erfolgte 1987 durch ihre Namensgeber, dem US-amerikanischen Chemiker Paul Dowd (1936–1996) und dem Australier Athelstan Beckwith (1930–2010).[1][2] Hauptanwendungsbereich ist die Synthese von cyclischen β-Ketoestern durch die Alkylierung mit einer Halogenmethylgruppe und anschließender radikalischer Reaktion mit AIBN und Tributylzinnhydrid.[3]
Übersichtsreaktion
[Bearbeiten | Quelltext bearbeiten]Ein am α-Kohlenstoffatom mit einer Halogenmethylgruppe substituierter, cyclischer β-Ketoester reagiert mit AIBN und Tributylzinnhydrid in einem radikalischen Mechanismus zu dem entsprechenden ringerweiterten cyclischen Ketoester.
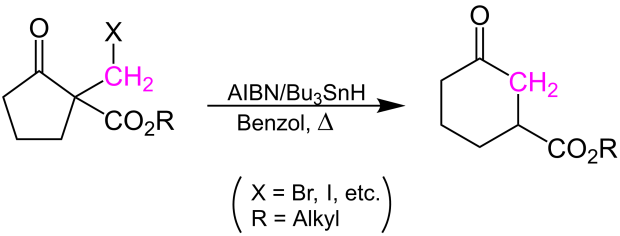
Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Der beschriebene Mechanismus[3] verläuft radikalisch. Mit einer Lösung aus dem Radikalstarter AIBN in Benzol wird zunächst das Halogen gebunden, sodass ein freies Radikal an der CH2 -Gruppe (Methylen-Gruppe) entsteht. Dieser instabile Zustand führt in einer innermolekularen radikalischen Addition unter Auflösung der Keto-Doppelbindung zu einem bicyclischen Übergangszustand. Anschließend kommt es zur Bildung des um die CH2 -Gruppe erweiterten Rings, wobei sich das freie Elektron an der Ester-Gruppe befindet. Durch Protonierung durch Zugabe von Tributylzinnhydrid entsteht der gewünschte cyclische β-Ketoester. Es wird vermutet, dass die Ester-Gruppe die vorbereitende Haloalykylierung erleichtert und die radikalische Addition unterstützt.
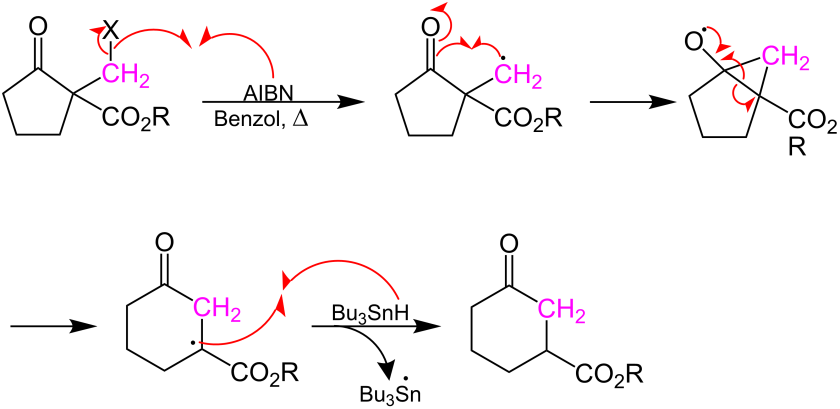
Grenzen der Reaktion
[Bearbeiten | Quelltext bearbeiten]Die Dowd-Beckwith-Ringerweiterung ist gut erforscht und ermöglicht eine Erweiterung des Rings von bis zu vier Kohlenstoff Atomen in einem Schritt.[3] Anstelle von Tributylzinnhydrid können sylilierte Cyclohexadiene als Protonendonator verwendet werden.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Paul Dowd, Soo Chang Choi: A new tributyltin hydride-based rearrangement of bromomethyl β-keto esters. A synthetically useful ring expansion to γ-keto esters. In: Journal of the American Chemical Society. Band 109, Nr. 11, 1987, S. 3493–3494, doi:10.1021/ja00245a069.
- ↑ Athelstan L. J. Beckwith, Dennis M. O’Shea, Sendaba Gerba, Steven W. Westwood: Cyano or acyl group migration by consecutive homolytic addition and β-fission. In: Journal of the Chemical Society, Chemical Communications. Nr. 9, 1987, S. 666–667, doi:10.1039/C39870000666.
- ↑ a b c Zerong Wang (Hrsg.): Comprehensive Organic Name Reactions and Reagents. John Wiley & Sons, Hoboken, New Jersey 2010, ISBN 978-0-470-63885-9, Clay-Kinnear-Perren Condensation, S. 939–941, doi:10.1002/9780470638859.conrr201.