Histoplasmose
| Klassifikation nach ICD-10 | |
|---|---|
| B39 | Histoplasmose |
| ICD-10 online (WHO-Version 2019) | |

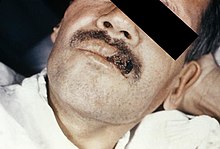
Die Histoplasmose (auch Retikuloendotheliale Zytomykose oder Darling-Krankheit) ist eine durch Pilze bedingte systemische Infektionskrankheit und wird durch Histoplasma-Arten, vor allem den Sprosspilz Histoplasma capsulatum, verursacht. Dem Vorkommen des Erregers entsprechend ist die Histoplasmose in Süd-, Mittel- und Teilen Nordamerikas, Indonesien und Afrika verbreitet. Fälle in Westeuropa sind die Ausnahme. Neben Erkrankungen des Menschen tritt die Histoplasmose auch beim Haushund auf.
In der Mehrzahl der Fälle ist bei dieser Mykose nur oder vorwiegend die Lunge befallen.
Pathologie
[Bearbeiten | Quelltext bearbeiten]Die Ansteckung mit dem im Erdboden lebenden dimorphen Pilz erfolgt durch Einatmen der Sporen. In der Lunge werden diese durch Makrophagen phagozytiert. Sie entwickeln sich innerhalb der Makrophagen zur Hefeform, die sich durch Sprossung vermehrt. Es kommt zur Bildung kleiner, zunächst epitheloidzelliger Granulome, die später zum Teil zentral eine „verkäsende“ Nekrose aufweisen. Die Abheilung erfolgt unter Verkalkung. Über den Blutkreislauf können Histoplasmen verschleppt werden und sekundär Lymphknoten, Leber und Milz befallen. Besonders das Retikuloendotheliale System ist in den Befall einbezogen.
Humanpathogen sind vor allem zwei Varietäten, wovon die Varietät capsulatum mit einem Durchmesser von 2–4 µm kleiner ist und die Varietät duboisii mit 6–12 µm etwas größer ist – und nur in Afrika vorkommt.[1]
Die Erreger der Histoplasmose sind unter anderem in Guano (Vogelkot als Dünger) und mit in diesem Zusammenhang kontaminierten Erdreich zu finden.[2]
Klinik
[Bearbeiten | Quelltext bearbeiten]Die meisten Infektionen verlaufen symptomlos und stumm, d. h., sie werden von den Erkrankten nicht bemerkt. Ausschlaggebend für etwaige Symptome ist die Infektionsdosis und die Abwehrlage des Wirtes. Nach einer Inkubationszeit von 3 bis 17 Tagen können sie sich als allgemeines Krankheitsgefühl, Fieber und trockener Husten manifestieren. Bei AIDS-Erkrankten und immunsupprimierten Patienten sind Histoplasmosen häufiger und verlaufen schwerer. Hier können schwere disseminierte (weitverteilte), geschwürige Gewebeschäden auftreten. Auch Todesfälle sind beschrieben.[3]
Diagnose
[Bearbeiten | Quelltext bearbeiten]Die Krankheit präsentiert sich klinisch auf unterschiedlichste Weise. Der Erreger kann in Blut, Biopsien oder bronchoalveolärer Lavage nachgewiesen werden. Mittels ELISA oder PCR ist es auch möglich Histoplasmose-Antigen in Blut oder Urin nachzuweisen. Aufgrund der langen Halbwertszeit der fungalen Antigene sinkt der Antigenspiegel bei Behandlung aber nur langsam, weshalb der Test auch nach erfolgreicher Behandlung noch längere Zeit positiv sein kann.[1] Auch ein Antikörpertest steht zur Verfügung. Auf Sabouraud-Dextrose-Agar kann der Pilz zum Nachweis kultiviert werden.
Therapie
[Bearbeiten | Quelltext bearbeiten]Bei immunkompetenten Personen verläuft die Erkrankung meist selbstlimitierend und bedarf keiner Behandlung.
Nur bei schweren disseminierten Verläufen ist eine Behandlung notwendig, die in schweren Fällen intravenös mit liposomalem Amphotericin B durchgeführt wird. Anschließend wird in schweren Fällen für ein Jahr oral mit Itraconazol behandelt, das bei weniger schweren Fällen auch eine alternative Primärtherapie darstellt. Bei pulmonarer Histoplasmose sind 6–12 Wochen Therapie in der Regel ausreichend.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Katrina A. Armstrong, Justine V. Cohen, Jo-Anne O. Shepard, Erik E. Folch, Michael K. Mansour, Jonathan A. Stefely: Case 16-2020: A 47-Year-Old Woman with Recurrent Melanoma and Pulmonary Nodules. New England Journal of Medicine 2020, Ausgabe 21 vom 21. Mai 2020, Seiten 2034–2043, DOI: 10.1056/NEJMcpc1916258
- ↑ C. Raselli, W. H. Reinhart, F. Fleisch: Histoplasmose: ein ungewöhnliches Feriensouvenir. In: DMW - Deutsche Medizinische Wochenschrift. Band 138, Nr. 7, 2013, ISSN 0012-0472, S. 313–316, doi:10.1055/s-0032-1332870.
- ↑ Karen M. Frank, D. Kyle Hogarth, Jonathan L. Miller, Saptarshi Mandal, Philip J. Mease, R. Jude Samulski, Glen A. Weisgerber, John Hart: Investigation of the cause of death in a gene-therapy trial. In: The New England Journal of Medicine. Bd. 361, Nr. 2, 2009, S. 161–169, PMID 19587341, doi:10.1056/NEJMoa0801066.