Kupfer(II)-selenid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
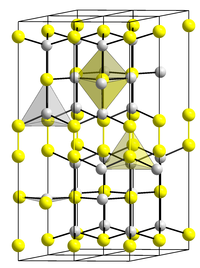
| ||||||||||||||||
| _ Cu2+ _ Se2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Kupfer(II)-selenid | |||||||||||||||
| Andere Namen |
Kupferselenid (mehrdeutig) | |||||||||||||||
| Verhältnisformel | CuSe | |||||||||||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 142,50 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
6,0–6,6 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Kupfer(II)-selenid ist eine anorganische chemische Verbindung des Kupfers aus der Gruppe der Selenide.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Kupfer(II)-selenid kommt natürlich in Form des Minerals Klockmannit vor.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Kupfer(II)-selenid kann durch peritektische Zersetzung von Kupferdiselenid CuSe2 (Kruťait) gewonnen werden.[3]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Kupfer(II)-selenid ist ein schwarzer Feststoff, der unlöslich in Wasser ist. Er ist löslich in Chlorwasserstoff unter Selenwasserstoffentwicklung und löslich in Schwefelsäure mit Schwefeldioxidentwicklung. Er wird durch Salpetersäure zu Kupfer(II)-selenit CuSeO3 oxidiert.[1] Kupfer(II)-selenid kommt in drei Modifikationen vor. Die bei Raumtemperatur vorliegende α-Form besitzt eine hexagonale Kristallstruktur vom Klockmannit-Typ mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) und ist isotyp zu der von Kupfer(II)-sulfid[4], die ab 51 °C vorliegende β-Form besitzt eine orthorhombische Kristallstruktur und die ab 157 °C vorliegende γ-Form wieder eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Nr. 194).[3]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Kupfer(II)-selenid wird als Halbleiter und als Katalysator beim Kjeldahlaufschluss verwendet.[1]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i Datenblatt Copper(II) selenide, 99.5% (metals basis) bei Alfa Aesar, abgerufen am 11. April 2014 (Seite nicht mehr abrufbar).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Selenverbindungen mit Ausnahme von Cadmiumsulfoselenid, soweit in diesem Anhang nicht gesondert aufgeführt im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 9. März 2021. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b D. J. Chakrabarti, D. E. Laughlin: The Cu/Se (Copper-Selenium) system. In: Bulletin of Alloy Phase Diagrams. 2, 1981, S. 305–315, doi:10.1007/BF02868284.
- ↑ Helmut Schröcke, Karl-Ludwig Weiner: Mineralogie: Ein Lehrbuch auf systematischer Grundlage – Helmut Schröcke, Karl-Ludwig Weiner. Walter de Gruyter, 1981, ISBN 3-11-083686-6, S. 223 (eingeschränkte Vorschau in der Google-Buchsuche).


