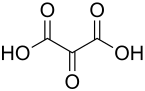
Mesoxalsäure
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Mesoxalsäure | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C3H2O5 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 118,04 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
sehr gut löslich in Wasser, Ethanol und Diethylether[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Mesoxalsäure ist sowohl eine Dicarbonsäure als auch eine Ketocarbonsäure und gibt leicht zwei Protonen unter Bildung des zweiwertigen Anions C3O52− ab. Mit Wasser bildet sie – als Ausnahme von der Erlenmeyer-Regel – ein stabiles, isolierbares Hydrat (2,2-Dihydroxymalonsäure).[3] Gleiches gilt für ihre Derivate, wie etwa die Ester.[1] Mesoxalsäure wirkt reduzierend, zum Beispiel bei der Tollensprobe; ihre thermische Stabilität ist gering. Beim Erhitzen zerfällt sie unter Abspaltung von Kohlenstoffdioxid (Decarboxylierung, zu Glyoxylsäure) bzw. Kohlenstoffmonoxid (Decarbonylierung, zu Oxalsäure).[1]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Mesoxalsäure findet sich in verschiedenen Pflanzen, so etwa der Zuckerrübe und der Luzerne.[1]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Sie kann durch Oxidation von Tartronsäure (Hydroxymalonsäure) an Platin-Bismut-Katalysatoren und Luft hergestellt werden.[4] Glycerin wird bei der Titration mit wässrigem Kaliumpermanganat quantitativ zur Mesoxalsäure oxidiert (CSB-Titration durch Manganometrie).[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Mesoxalsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Januar 2013.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie. 18. Auflage. S. Hirzel Verlag, Stuttgart 1978, ISBN 3-7776-0342-2, S. 297.
- ↑ P. Fordham, M. Besson, P. Gallezot: "Catalytic oxidation with air of tartronic acid to mesoxalic acid on bismuth-promoted platinum", in: Catal. Lett., 1997, 46 (3–4), S. 195–199; doi:10.1023/A:1019082905366.
- ↑ Dagegen oxidiert Kaliumdichromat wässriges Glycerin quantitativ zu Kohlendioxid.
