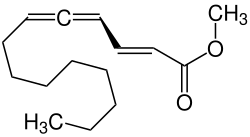
Methyltetradeca-2,4,5-trienoat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Methyltetradeca-2,4,5-trienoat | |||||||||
| Summenformel | C15H24O2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 236,35 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Methyltetradeca-2,4,5-trienoat ist ein allenischer Fettsäureester, der natürlich als Pheromon vorkommt.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
(R, E)-Methyltetradeca-2,4,5-trienoat kommt natürlich im Sexualpheromon männlicher (nicht aber weiblicher) Speisebohnenkäfer (Acanthoscelidus obtectus) vor. Die Menge, die jedes Individuum produziert, beträgt etwa 10–20 μg bzw. 0,5 % des Körpergewichts.[2] Das Pheromon, das Weibchen anzieht, besteht aus dieser und fünf weiteren Verbindungen.[3][4] Neben seiner Wirkung als Bestandteil des Pheromons, dient Methyltetradeca-2,4,5-trienoat auch zum Erkennen geeigneter Partner, die durch eine Abwesenheit der Verbindung gekennzeichnet sind. Einerseits können Männchen daran andere Männchen erkennen, andererseits übertragen Männchen auch bei der Paarung die Verbindung auf das Weibchen, sodass Männchen auch schon begattete von noch jungfräulichen Weibchen unterscheiden können.[5]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Der Naturstoff kann mit n-Hexan aus den Speisebohnenkäfern extrahiert werden.[2][6]
Eine Synthese der Verbindung ist ausgehend 3-Cyanopropanal[7] möglich. Dieses wird mit Ethinylmagnesiumbromid umgesetzt. Der entstehende racemische Alkohol wird mit enantiomerenreinem (R)-1-Naphthylethylisothiocyanat zu einem Carbamat umgesetzt. Durch Umsetzung mit Salzsäure und Methanol wird das Nitril in einen Methylester umgewandelt. Die zwei Diastereomere der Verbindung können durch Säulenchromatographie getrennt werden. Durch Reaktion mit einem Kupferorganyl (Lithiumdioctylcuprat) wird eine Octylgruppe eingeführt und bildet sich das chirale Allen mit hohem Enantiomerenüberschuss. Dabei wird auch die Carbamatgruppe abgespalten. Im letzten Schritt wird die trans-Doppelbindung durch Umsetzung mit Lithiumdiisopropylamid, Diphenyldiselenid und Natriumperiodat eingeführt.[8]
Eine andere Synthese baut das chirale Allen durch eine stereoselektive Claisen-Umlagerung (Johnson-Variante) auf.[9] Eine dritte Synthese funktioniert ebenfalls durch eine Claisen-Umlagerung nach einer enzymatischen, asymmetrischen Acetylierung.[10] Weitere Synthesen der Verbindung wurden publiziert.[3][11]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Reines Methyltetradeca-2,4,5-trienoat ist instabil und polymerisiert leicht. Die Halbwertszeit der Verbindung beträgt etwa 10 Stunden bei Raumtemperatur und 20 Tage bei −13 °C. Verdünnte Lösungen (z. B. in n-Hexan) sind jedoch selbst bei Raumtemperatur monatelang stabil. Die Verbindung ist chiral, die optische Aktivität kommt allein durch das Substitutionsmuster an der Allen-Substruktur zustande.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c D. F. Horler: (–) Methyl n-tetradeca-trans-2,4,5-trienoate, an allenic ester produced by the male Dried Bean beetle, Acanthoscelides obtectus(Say). In: J. Chem. Soc. Band 0, Nr. 6, 1970, S. 859–862, doi:10.1039/J39700000859.
- ↑ a b Kenji Mori: Pheromone synthesis. Part 257: Synthesis of methyl (2E,4Z,7Z)-2,4,7-decatrienoate and methyl (E)-2,4,5-tetradecatrienoate, the pheromone components of the male dried bean beetle, Acanthoscelides obtectus (Say). In: Tetrahedron. Band 71, Nr. 34, August 2015, S. 5589–5596, doi:10.1016/j.tet.2015.06.051.
- ↑ József Vuts, Wittko Francke, Kenji Mori, Paulo H. G. Zarbin, Antony M. Hooper, Jocelyn G. Millar, John A. Pickett, Miklós Tóth, Keith Chamberlain, John C. Caulfield, Christine M. Woodcock, Armin G. Tröger, Éva Bálintné Csonka, Michael A. Birkett: Pheromone Bouquet of the Dried Bean Beetle, Acanthoscelides obtectus (Col.: Chrysomelidae), Now Complete: The Complete Pheromone Bouquet of the Dried Bean Beetle. In: European Journal of Organic Chemistry. Band 2015, Nr. 22, August 2015, S. 4843–4846, doi:10.1002/ejoc.201500196.
- ↑ József Vuts, Stephen J. Powers, John C. Caulfield, John A. Pickett, Michael A. Birkett: Multiple Roles of a Male-Specific Compound in the Sexual Behavior of the Dried Bean Beetle, Acanthoscelides Obtectus. In: Journal of Chemical Ecology. Band 41, Nr. 3, März 2015, S. 287–293, doi:10.1007/s10886-015-0560-3.
- ↑ D.G.H. Halstead: Preliminary biological studies on the pheromone produced by male Acanthoscelides obtectus (Say) (Coleoptera, Bruchidae). In: Journal of Stored Products Research. Band 9, Nr. 2, August 1973, S. 109–117, doi:10.1016/0022-474X(73)90018-0.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-Cyanopropanal: CAS-Nr.: 3515-93-3, EG-Nr.: 222-518-8, ECHA-InfoCard: 100.020.472, PubChem: 77049, ChemSpider: 69495, Wikidata: Q72459014.
- ↑ W. H. Pirkle, Charles W. Boeder: Synthesis and absolute configuration of (−)-methyl (E)-2,4,5-tetradecatrienoate, the sex attractant of the male dried bean weevil. In: The Journal of Organic Chemistry. Band 43, Nr. 11, Mai 1978, S. 2091–2093, doi:10.1021/jo00405a001.
- ↑ Kenji Mori, Tomoo Nukada, Takashi Ebata: Synthesis of optically active forms of methyl (E)-2,4,5-tetradecatrienoate, the pheromone of the male dried bean beetle. In: Tetrahedron. Band 37, Nr. 7, Januar 1981, S. 1343–1347, doi:10.1016/S0040-4020(01)92450-0.
- ↑ Kenji Mori: Pheromone synthesis. Part 249: Syntheses of methyl (R,E)-2,4,5-tetradecatrienoate and methyl (2E,4Z)-2,4-decadienoate, the pheromone components of the male dried bean beetle, Acanthoscelides obtectus (Say). In: Tetrahedron. Band 68, Nr. 7, Februar 2012, S. 1936–1946, doi:10.1016/j.tet.2011.12.064.
- ↑ Masamichi Ogasawara, Takashi Nagano, Tamio Hayashi: A New Route to Methyl ( R,E )-(−)-Tetradeca-2,4,5-trienoate (Pheromone of Acanthoscelides obtectus ) Utilizing a Palladium-Catalyzed Asymmetric Allene Formation Reaction. In: The Journal of Organic Chemistry. Band 70, Nr. 14, 1. Juli 2005, S. 5764–5767, doi:10.1021/jo050684z.