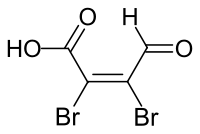
Mucobromsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Mucobromsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H2Br2O3 | ||||||||||||||||||
| Kurzbeschreibung |
beiger Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 257,86 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Mucobromsäure ist eine chemische Verbindung aus der Gruppe der ungesättigten Oxocarbonsäuren.
Gewinnung und Darstellung
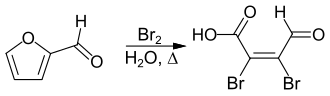
[Bearbeiten | Quelltext bearbeiten]Eine für eine industrielle Herstellung praktikable Synthese geht von Furfural aus, welches unter Ringöffnung oxidativ zur Mucobromsäure bromiert wird.[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]NMR- und UV-Untersuchungen zeigen, dass die Mucobromsäure in neutraler oder saurer Lösung als Lacton vorliegt und im basischen Medium zur offenkettigen Aldehydform tautomerisiert.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Durch Reduktion der Mucobromsäure mit Natriumborhydrid in Methanol und anschließender Aufarbeitung mit konzentrierter Schwefelsäure ist 3,4-Dibrom-2(5H)-furanon zugänglich, ein Zwischenprodukt für substituierte 2(5H)-Furanone und Tetronamide.[4][5]
Durch Umsetzung von Mucobromsäure mit Natriumnitrit erhält man das Natriumsalz von Nitromalondialdehyd, ein Zwischenprodukt zur Synthese von 2-Amino-5-nitropyrimidin[6] und anderer heterocyclischer Verbindungen.[7]
Mucobromsäure kann als Ausgangsmaterial zur Herstellung von Hexanitroethan verwendet werden.[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Mucobromic acid, 99% bei Sigma-Aldrich, abgerufen am 12. Dezember 2015 (PDF).
- ↑ G. A. Taylor: Organic Syntheses. American Cancer Society, 2003, ISBN 0-471-26422-9, Mucobromic Acid, S. 688, doi:10.1002/0471264180.os900.13 (orgsyn.org [PDF]).
- ↑ N. P. Buu-Hoi, M. Dufour, P. Jacquignon: ChemInform Abstract: Ring-Ketten-Tautomerie bei Mucochlor- und Mucobromsaeure und einigen ihrer Derivate. In: Chemischer Informationsdienst. Organische Chemie. Band 2, Nr. 50, 1971, doi:10.1002/chin.197150141.
- ↑ Selective synthesis of (Z)-4-aryl-5-[1-(aryl)methylidene]-3-bromo-2(5H)-furanones. In: Tetrahedron. Band 57, Nr. 50, 2001, S. 9997–10007, doi:10.1016/S0040-4020(01)01017-1.
- ↑ Silvio Cunha, Caio C. Oliveira, José R. Sabino: Synthesis of 3-bromotetronamides via amination of 3,4-dibromofuran-2(5H)-one. In: Journal of the Brazilian Chemical Society. Band 22, 2011, S. 598–603, doi:10.1590/S0103-50532011000300026.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2-Amino-5-nitropyrimidin: CAS-Nr.: 3073-77-6, EG-Nr.: 221-348-1, ECHA-InfoCard: 100.019.408, PubChem: 76490, ChemSpider: 68960, Wikidata: Q72440152.
- ↑ Sodium Nitromalonaldehyde Monohydrate. In: Organic Syntheses. Band 32, 1952, S. 95, doi:10.15227/orgsyn.032.0095.
- ↑ Patent US3101379: Synthesis of Hexanitroethane. Angemeldet am 4. Januar 1961, veröffentlicht am 20. August 1963, Anmelder: Lockheed Aircraft Corp., Erfinder: John A. Gallaghan, Wilmer L. Reed.