Natriummethanolat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
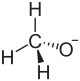 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriummethanolat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH3NaO | |||||||||||||||
| Kurzbeschreibung |
farbloses bis gelbliches, hygroskopisches, geruchloses Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 54,02 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,3 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser, gut löslich in wasserfreiem Methanol[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Natriummethanolat ist das Alkoholat des Methanols mit Natrium als Gegenion und das wichtigste der Methanolate.
Natriummethanolat sollte nicht mit Natriumethanolat (Summenformel C2H5NaO) verwechselt werden.
Darstellung[Bearbeiten | Quelltext bearbeiten]
Die Herstellung der Verbindung erfolgt über die Reaktion von Methanol mit elementarem Natrium oder mit Natriumhydrid. Daneben entsteht molekularer Wasserstoff.[4]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Natriummethanolat ist ein stark hygroskopischer weißer Feststoff.[1] Dieser ist sehr reaktiv und wird aus diesem Grund meist nur in Lösung gehandhabt und gelagert. Bei Temperaturen über 50 °C besteht an Luft die Gefahr der Selbstentzündung.[1]
Es ist eine sehr starke Base, die heftig mit Wasser und Säuren reagiert. Verglichen mit anderen Alkalimethanolaten ist es in methanolischen Lösungen basischer als Lithiummethanolat, aber weniger basisch als Kaliummethanolat.[5]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Natriummethanolat wird als Base beispielsweise zur Deprotonierung CH-acider Verbindungen verwendet.[5]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Autorenkollektiv: Organikum. 22. Auflage. Wiley-VCH, 2004, ISBN 978-3-527-31148-4.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h Eintrag zu Natriummethanolat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ Eintrag zu Sodium methanolate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Natriummethanolat bei Merck, abgerufen am 18. Januar 2011.
- ↑ Berthmann, Hausweiler, Martin Herrmann, Köster, Kröper, Ratz, Schimmelschmidt, Thomas Schmidt, Schwarzer, Simmler, Sinn: A. Herstellung von Metallalkoholaten, -phenolaten, -enolaten und –chelaten : I. Metallalkoholate (I). In: Georg Thieme Verlag eBooks. 1. Januar 1963, doi:10.1055/b-0035-114592.
- ↑ a b Yahya El-Kattan, Jeff McAtee, Bernard Bessieres: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2006, ISBN 0-471-93623-5, Sodium Methoxide, doi:10.1002/047084289x.rs089m.pub2.




