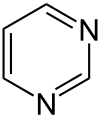
Pyrimidin
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pyrimidin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H4N2 | |||||||||||||||
| Kurzbeschreibung |
farblose bis orangefarbene Verbindung[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 80,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest bis flüssig | |||||||||||||||
| Dichte |
1,016 g·cm−3 (25 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
123–124 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
mischbar mit Wasser, Alkohol und Ether[3] | |||||||||||||||
| Brechungsindex |
1,504 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
145,9 kJ·mol−1 (flüssig)[5] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Pyrimidin ist ein sechsgliedriges heterocyclisches aromatisches Amin mit zwei Stickstoffatomen, das nach der systematischen Nomenklatur auch als 1,3-Diazin bezeichnet wird. Der Name leitet sich von gr. pyr = Hitze, Feuer (wegen der Verwandtschaft mit Pyridin) und der Stoffklasse der Amidine ab. Pyrimidin ist der Grundkörper der Stoffgruppe der Pyrimidine.
Struktur
Pyrimidin zählt als ein Aza-Analoges (Azalog) des Pyridins zu den heteroaromatischen Diazinen.

Herstellung
Pyrimidin wurde Ende des 19. Jahrhunderts erstmals von Siegmund Gabriel und James Colman aus Barbitursäure synthetisiert. Diese wurde mit Phosphoroxychlorid umgesetzt, wobei 2,4,6-Trichlorpyrimidin erhalten wurde. Enthalogenierung mit Zinkpulver führte zur Zielverbindung.[6] Enthalogenierungen wurden auch mit 2,4-Dichlorpyrimidin und Tetrachlorpyrimidin durchgeführt.[7]

Über 50 Jahre nach Gabriels Entdeckung wurde im Arbeitskreis um Hellmut Bredereck eine Synthese aus C3-Bausteinen und Formamid entwickelt. Als Substitut für den instabilen Malondialdehyd (Propandial) wurden dessen Tetraacetal, 1-Methoxy-1,3,3-triethoxypropan, der Enolether 1,3,3-Triethoxypropen und das Enamin 3-Diethylaminopropenal eingesetzt.[8][9]

Eigenschaften
Pyrimidin bildet farblose, charakteristisch riechende Kristalle, die schon oberhalb von 20–22 °C schmelzen.[2] Oberhalb des Schmelzpunktes liegt eine farblose Flüssigkeit mit einem Normaldrucksiedepunkt bei 124 °C vor.[10] Die molare Verdampfungsenthalpie beträgt 49,89 kJ·mol−1.[11] Die Verbrennungsenthalpie wurde mit −2288,9 kJ·mol−1, die Bildungsenthalpie mit 143,2 kJ·mol−1 bestimmt.[11] Die Verbindung ist in Wasser leicht löslich.[2] Mit Säuren bildet sie Salze.[2]
Literatur
- Brockhaus ABC Chemie, F.A. Brockhaus Verlag Leipzig 1971.
- J. A. Joule, G. F. Smith, Heterocyclic Chemistry, Second Edition, Van Nostrand Reinhold Company, London, 1978, ISBN 0-442-30212-6.
Einzelnachweise
- ↑ a b c d e f Eintrag zu Pyrimidin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Pyrimidin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Dezember 2014.
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, ISBN 978-0-911910-00-1, S. 1374.
- ↑ Datenblatt Pyrimidine bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ S. Gabriel, James Colman, Über das Pyrimidin, Berichte der deutschen chemischen Gesellschaft, 32: 1525–1538 (1899); doi:10.1002/cber.18990320231.
- ↑ The Merck Index, 11th Edition, Merck and Co., Rahway, USA, 1989, S. 1270.
- ↑ H. Bredereck, R. Gompper, G. Morlock: Formamid-Reaktionen, VIII. Eine Neue Pyrimidin-Synthese, Chemische Berichte 90, 942–952 (1957); doi:10.1002/cber.19570900613.
- ↑ H. Bredereck, R. Gompper, H. Herlinger: Formamid-Reaktionen, XI. Darstellung, Eigenschaften und Umsetzungen des Pyrimidins, Chemische Berichte, 91, 2832–2849 (1958); doi:10.1002/cber.19580911240.
- ↑ CRC Handbook of Data on Organic Compounds, 2nd Edition, Weast,R.C and Grasselli, J.G., ed(s)., CRC Press, Inc., Boca Raton, FL, 1989, 1.
- ↑ a b Nabavian, P.M.; Sabbah, R.; Chastel, R.; Laffitte, M., Thermodynamique de composes azotes. II. Etude thermochimique des acides aminobenzoiques, de la pyrimidine, de l'uracile et de la thymine., J. Chim. Phys., 1977, 74, S. 115–126.

