Steroid-17α-Hydroxylase
| Steroid-17α-Hydroxylase | ||
|---|---|---|

| ||
| Kristallstruktur von menschlichem Cytochrom P450 17A1 nach PDB 3ruk | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 511 Aminosäuren | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Name | CYP17A1 | |
| Externe IDs | ||
| Enzymklassifikationen | ||
| EC, Kategorie | 1.14.99.9, Monooxygenase | |
| Reaktionsart | Hydroxylierung | |
| Substrat | Steroid + AH2 + O2 | |
| Produkte | 17α-Hydroxysteroid + A + H2O | |
| EC, Kategorie | 4.2.1.30, Lyase | |
| Reaktionsart | Deacetylierung | |
| Substrat | 17alpha-Hydroxysteroid | |
| Produkte | 17-Keto-Steroid + Essigsäure | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Eukaryoten[1] | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 1586 | 13074 |
| Ensembl | ENSG00000148795 | ENSMUSG00000003555 |
| UniProt | P05093 | P27786 |
| Refseq (mRNA) | NM_000102 | NM_007809 |
| Refseq (Protein) | NP_000093 | NP_031835 |
| Genlocus | Chr 10: 102.83 – 102.84 Mb | Chr 19: 46.67 – 46.67 Mb |
| PubMed-Suche | 1586 | 13074
|
Die Steroid-17α-Hydroxylase (auch: Cytochrom P450 17, CYP17) ist das Enzym, das in Eukaryoten die Hydroxylierung und anschließende Deacetylierung von Steroiden an der 17-Position katalysiert. Diese Reaktion ist nicht nur für die Biosynthese der Hormone Dehydroepiandrosteron (DHEA) und Androstendion (ASD) notwendig, sondern auch beim Abbau von Steroiden (Biotransformation). Das Enzym ist wahrscheinlich ein Membranprotein. Mutationen im CYP17A1-Gen sind die Ursache für Adrenogenitales Syndrom Typ 5.[2]
Katalysierte Reaktionen
[Bearbeiten | Quelltext bearbeiten]Die hauptsächlich katalysierte Reaktion ist die Hydroxylierung:
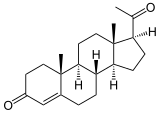 + AH2 + O2
+ AH2 + O2  + A + H2O
+ A + H2O
Als Beispiel ist die 17-Hydroxylierung von Progesteron zu 17α-Hydroxyprogesteron gezeigt. Auch Pregnenolon wird so hydroxyliert. Unter bestimmten Bedingungen wie Phosphorylierung des Enzyms und Vorhandenseins von genügend Elektronen kann Essigsäure abgespalten werden. Diese Reaktion heißt 17α-Hydroxyprogesteron-Aldolase (kurz: 17,20-Lyase) und findet am gleichen Zentrum wie die Hydroxylierung statt. Wie bei der Hydroxylierung kann auch das Pregnenolonderivat als Substrat herhalten:[3][4]
Klinische Bedeutung
[Bearbeiten | Quelltext bearbeiten]Der Hemmer der Steroid-17α-Hydroxylase Abirateron wird seit 2011 in der Therapie des kastrationsresistenten Prostatakrebs[5] genutzt.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Miller WL: Androgen biosynthesis from cholesterol to DHEA. In: Mol. Cell. Endocrinol. 198. Jahrgang, Nr. 1–2, Dezember 2002, S. 7–14, PMID 12573809.
- Auchus RJ: Overview of dehydroepiandrosterone biosynthesis. In: Semin. Reprod. Med. 22. Jahrgang, Nr. 4, November 2004, S. 281–8, doi:10.1055/s-2004-861545, PMID 15635496.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Jassal / reactome: Hydroxylation of pregnenolone to form 17alpha-hydroxypregnenolone
- Jassal / reactome: Side chain cleavage of 17alpha-hydroxypregnenolone to yield DHA
- Jassal / reactome: Hydroxylation of progesterone to form 17alpha-hydroxyprogesterone
- Jassal / reactome: Side chain cleavage of 17alpha-hydroxyprogesterone to yield 4-androstene-3,17-dione
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Homologe bei inParanoid
- ↑ UniProt P05093
- ↑ Bernhard Kleine: Hormone und Hormonsystem. 2. Auflage. Springer, Berlin 2010, ISBN 978-3-642-00901-3.
- ↑ Bhangoo A, Aisenberg J, Chartoffe A, et al.: Novel mutation in cytochrome P450c17 causes complete combined 17alpha-hydroxylase/17,20-lyase deficiency. In: J. Pediatr. Endocrinol. Metab. 21. Jahrgang, Nr. 2, Februar 2008, S. 185–90, PMID 18422032.
- ↑ C.J. Ryan et al.: Phase I clinical trial of the CYP17 inhibitor abiraterone acetate demonstrating clinical activity in patients with castration-resistant prostate cancer who received prior ketoconazole therapy. Journal of Clinical Oncology 28(9):1481-8,2010



