„Immunpräzipitation“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Ghilt (Diskussion | Beiträge) K →Siehe auch: korr wl |
Ghilt (Diskussion | Beiträge) ergänzt mit Ref, Beleg-Baustein entfernt |
||
| Zeile 1: | Zeile 1: | ||
Eine '''Immunpräzipitation''' (IP, auch Immunopräzipitation genannt) ist eine [[Biochemie|biochemische]] Methode, bei der in einem [[Pulldown-Assay]] mittels eines [[Antikörper]]s ein [[Antigen]] aus einer Lösung konzentriert wird.<ref>B. Kaboord, M. Perr: ''Isolation of proteins and protein complexes by immunoprecipitation.'' In: ''Methods Mol Biol.'' (2008), Band 424, S. 349-364. {{doi|10.1007/978-1-60327-064-9_27}}. PMID 18369874.</ref><ref>C. Dickson: ''Protein techniques: immunoprecipitation, in vitro kinase assays, and Western blotting.'' In: ''Methods Mol Biol.'' (2008), Band 461, S. 735-744. {{doi|10.1007/978-1-60327-483-8_53}}. PMID 19030838.</ref> |
|||
{{quellen}} |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | [[Datei:Immunpräzipitation Schema.png|mini|Schema einer Immunpräzipitation. Ein Lysat wird zusammen mit einem spezifischen [[Antikörper]] inkubiert. Dieser Antikörper bindet an sein Zielprotein und wird über [[Protein A]]- oder [[Protein G]]-Beads präzipitiert. Etwaige Interaktionspartner des Zielproteins, die an dieses gebunden sind, werden mit dem Zielprotein kopräzipitiert.]] |
||
| ⚫ | Das aufzureinigende Antigen ist meistens ein [[Biopolymer]], z. B. ein [[Protein]], [[Peptid]], [[Polysaccharid]] oder eine [[Nukleinsäure]] sein. Die Aufreinigung von Nukleinsäuren per Immunpräzipitation ist unter [[Chromatin-Immunpräzipitation]] beschrieben. In der Regel ist der Antikörper dabei ''[[in vitro]]'' an eine feste [[stationäre Phase]] ([[Vernetzung (Chemie)|quervernetzte]] [[Agarose]]- oder [[Dextran]]kügelchen) gekoppelt und bindet über seine [[Affinität (Biochemie)|Affinität]] ein spezifisches Antigen in einer Lösung, beispielsweise einem [[Gewebe (Biologie)|Gewebe]]lysat. Ein bestimmtes Antigen wird dabei mitsamt seinen [[Protein-Protein-Wechselwirkung|Interaktionspartnern]] (Copräzipitate) also aus einem Gemisch [[Präzipitation (Immunologie)|präzipitiert]]. Dadurch eignet sich die Immunpräzipitation auch zum Nachweis von Protein-Protein-Wechselwirkungen, da ganze [[Proteinkomplex]]e mit dieser Methode präzipitiert werden können. |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
[[Datei:Immunpräzipitation Schema.png|gerahmt|Schema einer Immunpräzipitation. |
|||
| ⚫ | Ein Lysat wird zusammen mit einem spezifischen [[Antikörper]] inkubiert. Dieser Antikörper bindet an sein Zielprotein und wird über Protein A |
||
Das Proteingemisch kann ein [[ |
Das Proteingemisch kann ein [[Zellaufschluss|Homogenisat]] eines Gewebes sein oder aber [[Zelle (Biologie)|Zelle]]n aus der [[Zellkultur]]. Die Zellkultur ermöglicht es dabei auch, die Partner der vermuteten Interaktion zu [[Überexpression|überexprimieren]], d.h. diese Proteine werden vermehrt gebildet. Der Interaktionspartner sollte in dieser Situation noch gebunden sein. Nachdem Zellen oder Gewebe aufgebrochen wurden, gibt man nun [[Antikörper]] hinzu, welche an eines der Proteine spezifisch binden. Über diese Antikörper wird dann das gesuchte Protein samt Interaktionspartner aus der Lösung per [[Zentrifugation]] oder [[MACS]] sedimentiert. Mehrere Waschschritte dienen der Entfernung unspezifisch gebundener Proteine. Die Proteine werden von den Beads durch [[Denaturierung (Biochemie)|Denaturierung]] gelöst und der Nachweis erfolgt meistens über einen [[Western Blot]]. |
||
Hierbei bedient man sich in der Regel der spezifischen Eigenschaften von so genanntem [[Protein A]], das aus der Zellwand des Bakteriums ''[[Staphylococcus aureus]]'' stammt, und/oder [[Protein G]], welches ein Bestandteil der Zellwand von bestimmten [[Streptokokken]]-Stämmen ist. Protein A und G binden mit hoher Spezifität an die Fc-Region der meisten [[Säugetier]]-[[Immunglobulin]]e. Mit diesen Proteinen werden nun Kügelchen beschichtet (sogenannte Beads, z.B. aus [[Sepharose]] oder magnetischen [[Mikropartikel]]n), um in einer solchen Immunpräzipitation die Antikörper-Protein-Komplexe an sich zu binden.<ref>S. C. Masters: ''Co-immunoprecipitation from transfected cells.'' In: ''Methods Mol Biol.'' (2004), Band 261, S. 337-350. PMID 15064468.</ref> |
|||
== Quantitative Immunpräzipitation == |
== Quantitative Immunpräzipitation == |
||
Ausgefallene oder lösliche Antigen-Antikörper Immunkomplexe trüben eine Lösung. Verwendet man gereinigte Antigenstandards so kann durch Messung der Trübung |
Ausgefallene oder lösliche Antigen-Antikörper Immunkomplexe trüben eine Lösung. Verwendet man gereinigte Antigenstandards so kann durch Messung der Trübung per [[Immunnephelometrie]] auf die Antigenkonzentration in der Probe geschlossen werden.<ref>Christine Schütt, Barbara Bröker: Grundwissen Immunologie, 2. Ausgabe, Springer, 2009, ISBN 9783827420275</ref> |
||
== Vor- und Nachteile == |
== Vor- und Nachteile == |
||
| ⚫ | Eingesetzt wird die IP im Zuge einer [[Proteinreinigung]] und [[Proteincharakterisierung]] als alternativer Nachweis einer Interaktion, z. B. nach einem [[Hefe-Zwei-Hybrid-System|Hefe-Zwei-Hybrid]]-Screen. Sie ermöglicht die Untersuchung von Protein-Protein-Interaktionen in zumindest ''[[in vivo]]''-ähnlichen Verhältnissen, d. h. im Milieu einer Zelle und mit in [[Eukaryoten]] vorkommenden [[posttranslationale Modifikation|posttranslationalen Modifikationen]] wie [[Glykosylierung]] (Anhängen von Zuckerketten), [[Palmitoylierung]] (Anhängen von Fettsäuren) oder einer Faltung durch [[Chaperon (Protein)|Chaperon]]e. |
||
Es ist aber möglich, dass sich Proteine durch das Aufbrechen der Zellen verändern oder auch [[Proteolyse|abgebaut]] werden. |
|||
| ⚫ | Eingesetzt wird die IP |
||
Ein weiteres Problem der Methode ist bei der Immunpräzipitation eine mangelnde Reinheit des bindenden Proteins, die zu [[falsch positiv]]en Ergebnissen führen kann. Weiterhin sind die Ergebnisse der Immunpräzipitation zum Teil von der spezifischen Bindung des Antikörpers abhängig, [[heterophile Antikörper]] können unspezifisch unerwünschte Proteine präzipitieren. Auf der anderen Seite binden manche Proteine auch direkt an die Beads oder an die Oberfläche der Reaktionsgefäße. Diese gebundenen Moleküle können eine nicht vorhandene Interaktion vorgaukeln ([[falsch positiv]]), welche nur über zusätzliche [[Kontrollversuch]]e behoben werden kann. Des Weiteren ist es möglich, dass zwei Proteine zwar im IP-Versuch interagieren, aber im [[Zellzyklus]], im [[Zellorganell]] oder im [[Zelltyp]] nicht gleichzeitig auftreten und deshalb nicht tatsächliche Interaktionspartner sein können. Da unter suboptimalen Umgebungsbedingungen auch [[falsch-negativ]]e Ergebnisse produziert werden können, dienen wiederholte Versuchsserien mit veränderten [[Puffer (Chemie)|Puffer]]bedingungen einer Minderung falsch-negativer Ergebnisse. |
|||
Es ist aber möglich, dass sich Proteine durch das Aufbrechen der Zellen verändern oder auch abgebaut werden. Der Erfolg der IP ist auch zu großem Maße von der Bindung des Antikörpers abhängig. Somit können leicht falsch-negative Ergebnisse produziert werden (''false negative''), die nur durch wiederholte Versuchsserien mit veränderten Bedingungen behoben werden können. Auf der anderen Seite binden manche Proteine auch direkt an die Beads oder an die Oberfläche der Reaktionsgefäße. Diese können eine nicht vorhandene Interaktion vorgaukeln (''false positive''), welche nur über zusätzliche Kontrollen behoben werden kann. |
|||
Des Weiteren ist es möglich, dass zwei Proteine zwar im IP-Versuch interagieren, aber im [[Zellzyklus]], im [[Zellorganell]] oder im [[Zelltyp]] nicht gleichzeitig auftreten und deshalb nicht tatsächliche Interaktionspartner sein können. |
|||
Aus den genannten Gründen muss die Interpretation von IP-Ergebnissen mit Vorsicht erfolgen. Positive Interaktionen müssen immer mit weiteren Techniken |
Aus den genannten Gründen muss die Interpretation von IP-Ergebnissen mit Vorsicht erfolgen. Positive Interaktionen müssen immer mit weiteren Techniken verifiziert werden, wie beispielsweise [[Hefe-Zwei-Hybrid-System]] oder [[FRET]]. Eine Immunpräzipitation gibt zwar Auskunft über die mögliche Interaktion von zwei Proteinen, jedoch keine Informationen darüber, ''wie'' diese Interaktion stattfindet. Dazu sind detailliertere Untersuchungen der Struktur der beteiligten Proteine nötig. |
||
== Einzelnachweise == |
== Einzelnachweise == |
||
Version vom 12. September 2013, 13:52 Uhr
Eine Immunpräzipitation (IP, auch Immunopräzipitation genannt) ist eine biochemische Methode, bei der in einem Pulldown-Assay mittels eines Antikörpers ein Antigen aus einer Lösung konzentriert wird.[1][2]
Prinzip
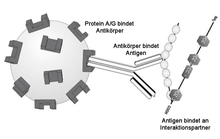
Das aufzureinigende Antigen ist meistens ein Biopolymer, z. B. ein Protein, Peptid, Polysaccharid oder eine Nukleinsäure sein. Die Aufreinigung von Nukleinsäuren per Immunpräzipitation ist unter Chromatin-Immunpräzipitation beschrieben. In der Regel ist der Antikörper dabei in vitro an eine feste stationäre Phase (quervernetzte Agarose- oder Dextrankügelchen) gekoppelt und bindet über seine Affinität ein spezifisches Antigen in einer Lösung, beispielsweise einem Gewebelysat. Ein bestimmtes Antigen wird dabei mitsamt seinen Interaktionspartnern (Copräzipitate) also aus einem Gemisch präzipitiert. Dadurch eignet sich die Immunpräzipitation auch zum Nachweis von Protein-Protein-Wechselwirkungen, da ganze Proteinkomplexe mit dieser Methode präzipitiert werden können.
Ein präzipitiertes Protein und seine Interaktionspartner können im Anschluss mit unterschiedlichen Methoden nachgewiesen werden, beispielsweise mit Immunkonjugaten in einem Western Blot, Peptidmassenfingerprint oder durch vorherige Markierung mit Radioimmunkonjugaten.
Das Proteingemisch kann ein Homogenisat eines Gewebes sein oder aber Zellen aus der Zellkultur. Die Zellkultur ermöglicht es dabei auch, die Partner der vermuteten Interaktion zu überexprimieren, d.h. diese Proteine werden vermehrt gebildet. Der Interaktionspartner sollte in dieser Situation noch gebunden sein. Nachdem Zellen oder Gewebe aufgebrochen wurden, gibt man nun Antikörper hinzu, welche an eines der Proteine spezifisch binden. Über diese Antikörper wird dann das gesuchte Protein samt Interaktionspartner aus der Lösung per Zentrifugation oder MACS sedimentiert. Mehrere Waschschritte dienen der Entfernung unspezifisch gebundener Proteine. Die Proteine werden von den Beads durch Denaturierung gelöst und der Nachweis erfolgt meistens über einen Western Blot.
Hierbei bedient man sich in der Regel der spezifischen Eigenschaften von so genanntem Protein A, das aus der Zellwand des Bakteriums Staphylococcus aureus stammt, und/oder Protein G, welches ein Bestandteil der Zellwand von bestimmten Streptokokken-Stämmen ist. Protein A und G binden mit hoher Spezifität an die Fc-Region der meisten Säugetier-Immunglobuline. Mit diesen Proteinen werden nun Kügelchen beschichtet (sogenannte Beads, z.B. aus Sepharose oder magnetischen Mikropartikeln), um in einer solchen Immunpräzipitation die Antikörper-Protein-Komplexe an sich zu binden.[3]
Quantitative Immunpräzipitation
Ausgefallene oder lösliche Antigen-Antikörper Immunkomplexe trüben eine Lösung. Verwendet man gereinigte Antigenstandards so kann durch Messung der Trübung per Immunnephelometrie auf die Antigenkonzentration in der Probe geschlossen werden.[4]
Vor- und Nachteile
Eingesetzt wird die IP im Zuge einer Proteinreinigung und Proteincharakterisierung als alternativer Nachweis einer Interaktion, z. B. nach einem Hefe-Zwei-Hybrid-Screen. Sie ermöglicht die Untersuchung von Protein-Protein-Interaktionen in zumindest in vivo-ähnlichen Verhältnissen, d. h. im Milieu einer Zelle und mit in Eukaryoten vorkommenden posttranslationalen Modifikationen wie Glykosylierung (Anhängen von Zuckerketten), Palmitoylierung (Anhängen von Fettsäuren) oder einer Faltung durch Chaperone.
Es ist aber möglich, dass sich Proteine durch das Aufbrechen der Zellen verändern oder auch abgebaut werden. Ein weiteres Problem der Methode ist bei der Immunpräzipitation eine mangelnde Reinheit des bindenden Proteins, die zu falsch positiven Ergebnissen führen kann. Weiterhin sind die Ergebnisse der Immunpräzipitation zum Teil von der spezifischen Bindung des Antikörpers abhängig, heterophile Antikörper können unspezifisch unerwünschte Proteine präzipitieren. Auf der anderen Seite binden manche Proteine auch direkt an die Beads oder an die Oberfläche der Reaktionsgefäße. Diese gebundenen Moleküle können eine nicht vorhandene Interaktion vorgaukeln (falsch positiv), welche nur über zusätzliche Kontrollversuche behoben werden kann. Des Weiteren ist es möglich, dass zwei Proteine zwar im IP-Versuch interagieren, aber im Zellzyklus, im Zellorganell oder im Zelltyp nicht gleichzeitig auftreten und deshalb nicht tatsächliche Interaktionspartner sein können. Da unter suboptimalen Umgebungsbedingungen auch falsch-negative Ergebnisse produziert werden können, dienen wiederholte Versuchsserien mit veränderten Pufferbedingungen einer Minderung falsch-negativer Ergebnisse.
Aus den genannten Gründen muss die Interpretation von IP-Ergebnissen mit Vorsicht erfolgen. Positive Interaktionen müssen immer mit weiteren Techniken verifiziert werden, wie beispielsweise Hefe-Zwei-Hybrid-System oder FRET. Eine Immunpräzipitation gibt zwar Auskunft über die mögliche Interaktion von zwei Proteinen, jedoch keine Informationen darüber, wie diese Interaktion stattfindet. Dazu sind detailliertere Untersuchungen der Struktur der beteiligten Proteine nötig.
Einzelnachweise
- ↑ B. Kaboord, M. Perr: Isolation of proteins and protein complexes by immunoprecipitation. In: Methods Mol Biol. (2008), Band 424, S. 349-364. doi:10.1007/978-1-60327-064-9_27. PMID 18369874.
- ↑ C. Dickson: Protein techniques: immunoprecipitation, in vitro kinase assays, and Western blotting. In: Methods Mol Biol. (2008), Band 461, S. 735-744. doi:10.1007/978-1-60327-483-8_53. PMID 19030838.
- ↑ S. C. Masters: Co-immunoprecipitation from transfected cells. In: Methods Mol Biol. (2004), Band 261, S. 337-350. PMID 15064468.
- ↑ Christine Schütt, Barbara Bröker: Grundwissen Immunologie, 2. Ausgabe, Springer, 2009, ISBN 9783827420275