„Fluoreszenzmarkierung“ – Versionsunterschied
Ghilt (Diskussion | Beiträge) Die '''Fluoreszenzmarkierung''' ist eine Methode der Biochemie zur Markierung von Biomolekülen mit Fluorophoren. |
(kein Unterschied)
|
Version vom 23. Januar 2014, 00:53 Uhr

Die Fluoreszenzmarkierung ist eine Methode der Biochemie zur Markierung von Biomolekülen mit Fluorophoren.
Prinzip
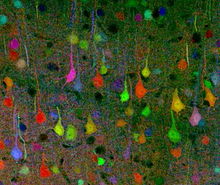
Biomoleküle werden gelegentlich zur erleichterten Verfolgung mit fluoreszenten Molekülen versehen.[2] Durch die Kopplung von Fluorophoren an Proteine oder Kohlenhydrate auf der Zelloberfläche können auch Zellen direkt markiert werden oder mit fluoreszenten Immunkonjugaten indirekt nachgewiesen werden,[3] z. B. per Durchflusszytometrie, Fluoreszenzmikroskopie oder Fluoreszenztomographie.
Proteine

Bei Proteinen werden in vivo unter anderem das grün fluoreszierende Protein (GFP) als rekombinantes Fusionsprotein oder als Reportergen verwendet.[4] Inteine können zur C-terminalen Markierung von Proteinen eingesetzt werden. Als fluoreszentes Protein-Tag kann auch das Flash-Tag verwendet werden.
Proteine können auch teilsynthetisch (bioorthogonal) markiert werden, in dem reaktive Aminosäurederivate in vivo eingebaut werden, die im Anschluß in vitro mit einem Fluorophor gekoppelt werden. Weiterhin werden Proteine mit verschiedenen chemischen Kopplungsreaktionen in vitro mit unterschiedlichen Fluorophoren versehen. Beispielsweise können nukleophile Gruppen (am häufigsten kommen Aminogruppen in Proteinen vor) durch Isothiocyanate mit unterschiedlichen Fluoreszenzfarbstoffen wie z. B. Fluorescein (FITC), Rhodamin und deren Derivate markiert werden. Proteine können auch indirekt durch eine Immunmarkierung mit fluoreszenten Immunkonjugaten nachgewiesen werden, z. B. bei der Fluoreszenzmikroskopie, dem Western Blot und dem Immunoassay. Im Zuge einer Peptidsynthese können Peptide durch Verwendung von fluoreszenten Aminosäurederivaten markiert werden. Durch einen Förster-Resonanzenergietransfer oder eine Bimolekulare Fluoreszenzkomplementation kann mit Fluorophoren die Nachbarschaft zweier Proteine nachgewiesen werden.
Nukleinsäuren
DNA kann bioorthogonal markiert werden. Dazu kann DNA in vivo oder in vitro mit Nukleosidanaloga markiert werden, welche z. B. anschließend per Staudinger-Reaktion mit einem Fluorophor gekoppelt werden können.[5] DNA kann chemisch mit Fluorophoren versehen werden.[6] Oligonukleotide können durch eine Phosphoramidit-Synthese mit Fluorophoren markiert werden, die z. B. in der QPCR, der DNA-Sequenzierung und der In-situ-Hybridisierung verwendet werden. Daneben kann DNA enzymatisch im Zuge einer Polymerasekettenreaktion mit fluoreszenten Nukleotiden erzeugt oder mit einer Ligase oder einer terminalen Desoxynukleotidyltransferase markiert werden.[7][8][9] DNA kann indirekt durch eine Biotinylierung und fluoreszentem Avidin nachgewiesen werden. Als Fluorophore werden für Kopplungen unter anderem Fluorescein, fluoreszente Lanthanide, Gold-Nanopartikel, Kohlenstoffnanoröhren oder Quantenpunkte eingesetzt.[6]
Einzelnachweise
- ↑ S. J. Smith: Circuit reconstruction tools today. In: Current opinion in neurobiology. Band 17, Nummer 5, Oktober 2007, S. 601–608, ISSN 0959-4388. doi:10.1016/j.conb.2007.11.004. PMID 18082394. PMC 2693015 (freier Volltext).
- ↑ C. P. Toseland: Fluorescent labeling and modification of proteins. In: Journal of chemical biology. Band 6, Nummer 3, April 2013, S. 85–95, ISSN 1864-6158. doi:10.1007/s12154-013-0094-5. PMID 24432126. PMC 3691395 (freier Volltext).
- ↑ S. Lindström: Flow cytometry and microscopy as means of studying single cells: a short introductional overview. In: Methods in molecular biology (Clifton, N.J.). Band 853, 2012, S. 13–15, ISSN 1940-6029. doi:10.1007/978-1-61779-567-1_2. PMID 22323136.
- ↑ D. Jung, K. Min, J. Jung, W. Jang, Y. Kwon: Chemical biology-based approaches on fluorescent labeling of proteins in live cells. In: Molecular bioSystems. Band 9, Nummer 5, Mai 2013, S. 862–872, ISSN 1742-2051. doi:10.1039/c2mb25422k. PMID 23318293.
- ↑ C. C. Wang, T. S. Seo, Z. Li, H. Ruparel, J. Ju: Site-specific fluorescent labeling of DNA using Staudinger ligation. In: Bioconjugate chemistry. Band 14, Nummer 3, 2003 May-Jun, S. 697–701, ISSN 1043-1802. doi:10.1021/bc0256392. PMID 12757398.
- ↑ a b L. J. Kricka, P. Fortina: Analytical ancestry: "firsts" in fluorescent labeling of nucleosides, nucleotides, and nucleic acids. In: Clinical chemistry. Band 55, Nummer 4, April 2009, S. 670–683, ISSN 1530-8561. doi:10.1373/clinchem.2008.116152. PMID 19233914.
- ↑ J. M. Prober, G. L. Trainor, R. J. Dam, F. W. Hobbs, C. W. Robertson, R. J. Zagursky, A. J. Cocuzza, M. A. Jensen, K. Baumeister: A system for rapid DNA sequencing with fluorescent chain-terminating dideoxynucleotides. In: Science (1987), Band 238(4825), S. 336–41. PMID 2443975.
- ↑ R. W. Richardson, R. I. Gumport: Biotin and fluorescent labeling of RNA using T4 RNA ligase. In: Nucleic acids research. Band 11, Nummer 18, September 1983, S. 6167–6184, ISSN 0305-1048. PMID 6194506. PMC 326365 (freier Volltext).
- ↑ H. Eshaghpour, D. Söll, D. M. Crothers: Specific chemical labeling of DNA fragments. In: Nucleic acids research. Band 7, Nummer 6, November 1979, S. 1485–1495, ISSN 0305-1048. PMID 228251. PMC 342322 (freier Volltext).