„Transthyretin“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K Der Name '''Präalbumin''' ist veraltet bzw. irreführend; Transthyretin ist keine Vorstufe von Albumin |
K Aussage zu Erkrankungen / Fehlfaltung präzisiert und aktuelle, geprüfte Quellen ergänzt |
||
| Zeile 35: | Zeile 35: | ||
| Orthologe = |
| Orthologe = |
||
}} |
}} |
||
'''Transthyretin''' (''TTR'', ''Thyroxin bindendes Präalbumin'', ''TBPA'') ist ein Serum-[[Transportprotein]] in [[Wirbeltiere]]n, das beim Menschen vorwiegend im [[Plexus choroideus]] und in der [[Leber]] gebildet wird. Es ist am Transport |
'''Transthyretin''' (''TTR'', ''Thyroxin bindendes Präalbumin'', ''TBPA'') ist ein Serum-[[Transportprotein]] in [[Wirbeltiere]]n, das beim Menschen vorwiegend im [[Plexus choroideus]] und in der [[Leber]] gebildet wird. Es ist am Transport des [[Schilddrüsenhormon]] [[Thyroxin]] (T4) beteiligt. |
||
In der [[Serumelektrophorese]] wandert Transthyretin vor der [[Albumin]]fraktion, woher sich auch sein veralteter Name '''Präalbumin''' ableitet. Es ist jedoch keine Vorstufe von Albumin, wie dieser Name vermuten lassen könnte und wie teils auch fälschlich in der Fachliteratur geschrieben steht.<ref name=Sedivy2007>{{Literatur |
In der [[Serumelektrophorese]] wandert Transthyretin vor der [[Albumin]]fraktion, woher sich auch sein veralteter Name '''Präalbumin''' ableitet. Es ist jedoch keine Vorstufe von Albumin, wie dieser Name vermuten lassen könnte und wie teils auch fälschlich in der Fachliteratur geschrieben steht.<ref name=Sedivy2007>{{Literatur |
||
| Zeile 50: | Zeile 50: | ||
}}</ref> Transthyretin ist beteiligt an der Bindung von Thyroxin und Retinol und hat eine [[molare Masse]] von ca. 55 kDa. Bei chronisch-aktiven Entzündungszuständen ist Transthyretin vermindert. Es wird daher als Anti-[[Akute-Phase-Protein]] bezeichnet. |
}}</ref> Transthyretin ist beteiligt an der Bindung von Thyroxin und Retinol und hat eine [[molare Masse]] von ca. 55 kDa. Bei chronisch-aktiven Entzündungszuständen ist Transthyretin vermindert. Es wird daher als Anti-[[Akute-Phase-Protein]] bezeichnet. |
||
Im Blut liegt Transthyretin vor allem als [[Tetramer]] vor, das jedoch in Monomere zerfallen kann, die anfällig für [[Proteinfehlfaltungserkrankung|Fehlfaltung]] sind. Bestimmte Mutationen des Transthyretin-Gens können diese Anfälligkeit verstärken.<ref name=Coelho2016>{{Literatur | Autor=Teresa Coelho, Giampaolo Merlini, Christine E Bulawa, James A Fleming, Daniel P Judge, Jeffery W Kelly, Mathew S Maurer, Violaine Planté-Bordeneuve, Richard Labaudinière, Rajiv Mundayat, Steve Riley, Ilise Lombardo, Pedro Huertas | Titel= Mechanism of Action and Clinical Application of Tafamidis in Hereditary Transthyretin Amyloidosis | Sammelwerk=Neurol Ther | Band=5 | Nummer=1 | Datum=2016 | Seiten=1-25 | DOI=10.1007/s40120-016-0040-x | PMID=26894299 | PMC=4919130}}</ref> Fehlgefaltetes Transthyretin kann sich in Form von [[Amyloid]]en im Gewebe anreichern und dadurch zu einer [[Amyloidose]] führen. Bei mutiertem Transthretin kann dies eine vererbliche Amyloidose mit autosomal-dominantem Erbgang sein, beispielsweise eine [[Familiäre Amyloidpolyneuropathie Typ I]] oder Typ II, s. [[Amyloid-Polyneuropathie#Familiäre Amyloidpolyneuropathien|Familiäre Amyloidpolyneuropathien]]. Im Alter kann fehlgefaltetes Transthyretin an der Entstehung einer senilen [[Amyloidose]] ([[Amyloidose#ATTR-Amyloidose|ATTR-Amyloidose]]) beteiligt sein. Darüber hinaus kann es bei pathologisch verändertem Transthyretin zu einer [[Hyperthyroxinämie]] kommen.<ref name=>{{Literatur | Autor=Peter Altmeyer | Titel=Transthyretin | Sammelwerk=Altmeyers Enzyklopädie | Datum=2018-07-24 | Online=https://www.altmeyers.org/de/innere-medizin/transthyretin-15264 | Abruf=2021-06-04}}</ref> |
|||
Im Alter ist Transthyretin an der Entstehung der senilen [[Amyloidose]] ([[Amyloidose#ATTR-Amyloidose|ATTR-Amyloidose]]) beteiligt. |
|||
Genetisch veränderte Varianten des Transthyretin können zu vererblichen Amyloidosen mit autosomal-dominantem Erbgang führen wie [[Familiäre Amyloidpolyneuropathie Typ I]] oder Typ II, s. [[Amyloid-Polyneuropathie#Familiäre Amyloidpolyneuropathien|Familiäre Amyloidpolyneuropathien]]. |
|||
== Siehe auch == |
== Siehe auch == |
||
Version vom 4. Juni 2021, 17:02 Uhr
| Transthyretin | ||
|---|---|---|
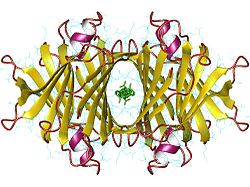
| ||
| Transthyretin tetramer, Human nach PDB 2ROX | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 127 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotetramer | |
| Bezeichner | ||
| Gen-Name | TTR | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Wirbeltiere[1] | |
Transthyretin (TTR, Thyroxin bindendes Präalbumin, TBPA) ist ein Serum-Transportprotein in Wirbeltieren, das beim Menschen vorwiegend im Plexus choroideus und in der Leber gebildet wird. Es ist am Transport des Schilddrüsenhormon Thyroxin (T4) beteiligt.
In der Serumelektrophorese wandert Transthyretin vor der Albuminfraktion, woher sich auch sein veralteter Name Präalbumin ableitet. Es ist jedoch keine Vorstufe von Albumin, wie dieser Name vermuten lassen könnte und wie teils auch fälschlich in der Fachliteratur geschrieben steht.[2] Transthyretin ist beteiligt an der Bindung von Thyroxin und Retinol und hat eine molare Masse von ca. 55 kDa. Bei chronisch-aktiven Entzündungszuständen ist Transthyretin vermindert. Es wird daher als Anti-Akute-Phase-Protein bezeichnet.
Im Blut liegt Transthyretin vor allem als Tetramer vor, das jedoch in Monomere zerfallen kann, die anfällig für Fehlfaltung sind. Bestimmte Mutationen des Transthyretin-Gens können diese Anfälligkeit verstärken.[3] Fehlgefaltetes Transthyretin kann sich in Form von Amyloiden im Gewebe anreichern und dadurch zu einer Amyloidose führen. Bei mutiertem Transthretin kann dies eine vererbliche Amyloidose mit autosomal-dominantem Erbgang sein, beispielsweise eine Familiäre Amyloidpolyneuropathie Typ I oder Typ II, s. Familiäre Amyloidpolyneuropathien. Im Alter kann fehlgefaltetes Transthyretin an der Entstehung einer senilen Amyloidose (ATTR-Amyloidose) beteiligt sein. Darüber hinaus kann es bei pathologisch verändertem Transthyretin zu einer Hyperthyroxinämie kommen.[4]
Siehe auch
Einzelnachweise
- ↑ Homologe bei OMA.
- ↑ Sedivy, Roland: Pathologie in Fallstudien: Historische Präparate neu betrachtet. 2007, S. 132 (Volltext in der Google-Buchsuche [abgerufen am 4. Juni 2021]).
- ↑ Teresa Coelho, Giampaolo Merlini, Christine E Bulawa, James A Fleming, Daniel P Judge, Jeffery W Kelly, Mathew S Maurer, Violaine Planté-Bordeneuve, Richard Labaudinière, Rajiv Mundayat, Steve Riley, Ilise Lombardo, Pedro Huertas: Mechanism of Action and Clinical Application of Tafamidis in Hereditary Transthyretin Amyloidosis. In: Neurol Ther. Band 5, Nr. 1, 2016, S. 1–25, doi:10.1007/s40120-016-0040-x, PMID 26894299, PMC 4919130 (freier Volltext).
- ↑ Peter Altmeyer: Transthyretin. In: Altmeyers Enzyklopädie. 24. Juli 2018 (altmeyers.org [abgerufen am 4. Juni 2021]).