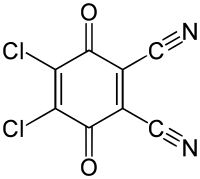
2,3-Dichlor-5,6-dicyano-1,4-benzochinon
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | 2,3-Dichlor-5,6-dicyano-1,4-benzochinon | |||||||||
| Andere Namen |
DDQ | |||||||||
| Summenformel | C8Cl2N2O2 | |||||||||
| Kurzbeschreibung |
gelbes bis oranges Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 227,00 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
2,3-Dichlor-5,6-dicyano-1,4-benzochinon (oder DDQ von englisch 2,3-Dichloro-5,6-dicyano-1,4-benzoquinone) ist eine organische Verbindung und findet als oxidatives Reagenz in der Organischen Chemie seine Anwendung. DDQ wird zur oxidativen Dehydrogenierung von Alkoholen[2], Phenolen[3] und steroiden Ketonen[4] angewandt. Auch in der Schutzgruppentechnik wird DDQ in der Spaltung von p-Methoxy- und 3,4-Dimethoxybenzylethern benutzt.[5] DDQ wird in Wasser zersetzt, ist jedoch stabil in Gegenwart wässriger Mineralsäuren.
Synthese
Im Jahr 1906 wurde von Johannes Thiele und Fritz Günther ein Reaktionssequenz aus Cyanierung, Chlorierung von 1,4-Benzochinon publiziert.[6] Eine einstufige Reaktion zur Synthese von DDQ wurde 1965 von Derek Walker und Thomas D. Waugh ausgehend von 2,3-Dicyanohydrochinon berichtet.[2]
Stabilität
DDQ wird von Wasser unter Abspaltung der sehr giftigen Blausäure (HCN) hydrolysiert. Niedrige Temperaturen und eine schwach saure Umgebung erhöhen die Stabilität.
Verwendung
DDQ ist ein Reagenz, welches zur Oxidation und als Radikalakzeptor seine Anwendung besitzt.
Reaktionen
Dehydrogenierung
DDQ kann zur Dehydrierung von α,β-ungesättigten Carbonylverbindungen, wie am Beispiel eines Steroids gezeigt, verwendet werden.
Aromatisierung
In Anwesenheit von Säuren werden durch Dehydrierung aromatisierte Steroide zugänglich.[7]
Oxidative Kupplungsreaktionen
DDQ kann auch für oxidative Kupplungen verwendet werden.[8]
Einzelnachweise
- ↑ a b c d e f g Vorlage:Acros
- ↑ a b Braude. E.A,, Linstead, R. P., and Wooldridge, K. R. H.: Hydrogen Transfer. 9. The selective dehydrogenation of unsaturated alcohols by high-potential quinones. In: Journal of the American Chemical Society. August 1956, S. 3070–3074, doi:10.1039/JR9560003070.
- ↑ Becker. H.D,: Quinone Dehydrogenation .I. Oxidation Of Monohydric Phenols. In: Journal of Organic Chemistry. 30. Jahrgang, Nr. 4, 1965, S. 982–989, doi:10.1021/jo01015a006.
- ↑ A.B. Turner, H.J Ringold: Applications of high-potential quinones. Part I. The mechanism of dehydrogenation of steroidal ketones by 2,3-dichloro-5,6-dicyanobenzoquinone. In: Journal of the Chemical Society. 1967, S. 1720–1730, doi:10.1039/J39670001720.
- ↑ Yuji Oikawa, Tadao Yoshioka, Osamu Yonemitsu: „Specific removal of o-methoxybenzyl protection by DDQ oxidation“, in: Tetrahedron Lett., 1982, 23, S. 885–888; doi:10.1016/S0040-4039(00)86974-9.
- ↑ Johannes Thiele, Fritz Günther: Ueber Abkömmlinge des Dicyanhydrochinons, in: Justus Liebigs Annalen der Chemie, 1906, Volume 349, Issue 1, S. 45–66; doi:10.1002/jlac.19063490103.
- ↑ Brown.W, Turner. AB, A. B. Turner: Application of High-potential Quinones. 7. Synthesis of steroidal phenanthrenes by double methyl migration. In: J. Chem. Soc. C. Nr. 14, 1971, S. 2566–2572, doi:10.1039/J39710002566.
- ↑ YH.Zhang, CJ. Li, and Wooldridge, K. R. H.: DDQ-Mediated Direct Cross-Dehydrogenative-Coupling (CDC) between Benzyl Ethers and Simple Ketones. In: Journal of the American Chemical Society. 128. Jahrgang, Nr. 13, 2006, S. 4242–4243, doi:10.1021/ja060050p.
Weblinks
- "Like Neurons in the Brain": A Molecular Computer that Evolves ( vom 12. Dezember 2010 im Internet Archive)





