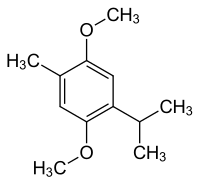
2,5-Dimethoxy-p-cymol
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | 2,5-Dimethoxy-p-cymol | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C12H18O2 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 194,27 g·mol−1 | ||||||||||||
| Dichte |
0,998 g·cm−3 (22 °C)[1] | ||||||||||||
| Siedepunkt |
248–250 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
2,5-Dimethoxy-p-cymol ist eine aromatische Verbindung, mit zwei Methoxygruppen, sowie einer Methylgruppe und einer Isopropylgruppe. Man kann es auch als Derivat von p-Cymol oder 1,4-Dimethoxybenzol auffassen.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
2,5-Dimethoxy-p-cymol kommt natürlich im Öl von Apium leptophyllum, Arnica montana und Eupatorium spp. vor.[1] Es kommt auch in Ayapana triplinervis[3], Cyclospermum leptophyllum[4], Tabakrauch[5] und Blumea perrottetiana[6] und weiteren vor.
Die Gehalte von 2,5-Dimethoxy-p-cymol in verschiedenen Ölen:
- Ayapana triplinervis (92,8 %)[7]
- Apium leptophyllum (50,7 bis 80,24 %)[8][9]
- Cyathocline purpurea (57,4 %)[10]
- Arnica montana (32,6 %)[11]
- Laggera crispata (32,2 %)[12]
- Blumea perrottetiana (30,0 %)[13]
- Eupatorium capillifolium (20,8 %)[14]
- Sphaeranthus indicus (18,2 %)[15]
- Limbarda crithmoides (16,4 %)[16]
- Bubonium imbricatum (16,2 %)[17]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
2,5-Dimethoxy-p-cymol kann durch aromatische Halogenierung von Carvacrol, gefolgt von nukleophiler Substitution mit Natriummethoxid und Williamson-Ether-Synthese unter Verwendung von Methyliodid gewonnen werden.[18]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Dictionary of Terpenoids. CRC Press, 1991, ISBN 978-0-412-25770-4, S. 93 (books.google.de).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Anne Gauvin-Bialecki, Claude Marodon: Essential oil of Ayapana triplinervis from Reunion Island: A good natural source of thymohydroquinone dimethyl ether. In: Biochemical Systematics and Ecology. Band 36, Nr. 11, S. 853–858, doi:10.1016/j.bse.2008.09.006.
- ↑ C. Pande, G. Tewari, C. Singh & S. Singh: Essential oil composition of aerial parts of Cyclospermum leptophyllum (Pers.) Sprague ex Britton and P. Wilson. In: Natural Product Research. Band 25, Nr. 6, 2011, S. 592–595, doi:10.1080/14786419.2010.487190, PMID 21409720.
- ↑ The Chemical Components of Tobacco and Tobacco Smoke, Second Edition. CRC Press, 2016, ISBN 978-1-4665-1552-9, S. 1733 (books.google.de).
- ↑ Medicinal Plant Research in Africa: Pharmacology and Chemistry. Newnes, 2013, ISBN 978-0-12-405936-8, S. 206 (books.google.de).
- ↑ Anne Gauvin-Bialecki, Claude Marodon: Essential oil of Ayapana triplinervis from Reunion Island: A good natural source of thymohydroquinone dimethyl ether. In: Biochemical Systematics and Ecology. 36. Jahrgang, Nr. 11, November 2008, S. 853–858, doi:10.1016/j.bse.2008.09.006.
- ↑ C. Pande, G. Tewari, C. Singh, S. Singh: Essential oil composition of aerial parts of Cyclospermum leptophyllum (Pers.) Sprague ex Britton and P. Wilson. In: Natural Product Research. 25. Jahrgang, Nr. 6, 2011, S. 592–595, doi:10.1080/14786419.2010.487190.
- ↑ Iman E. Helal, Amal A. Galala, Hassan-Elrady A. Saad, Ahmed F. Halim: Chemical composition and α-amylase inhibitory activity of Apium leptophyllum essential oils. In: The Journal of American Science. 11. Jahrgang, Nr. 4, 2015, S. 204–209, doi:10.7537/marsjas110415.23.
- ↑ Rajesh K. Joshi: Chemical constituents and antibacterial property of the essential oil of the roots of Cyathocline purpurea. In: Journal of Ethnopharmacology. 145. Jahrgang, Nr. 2, 2013, S. 621–625, doi:10.1016/j.jep.2012.11.045, PMID 23220198.
- ↑ Dejan Pljevljakušić, Dragana Rančić, Mihailo Ristić, Ljubodrag Vujisić, Dragoja Radanović, Zora Dajić-Stevanović: Rhizome and root yield of the cultivated Arnica montana L., chemical composition and histochemical localization of essential oil. In: Industrial Crops and Products. 39. Jahrgang, 2012, S. 177–189, doi:10.1016/j.indcrop.2012.02.030.
- ↑ Verma Ram S., Padalia Rajendra C., Chanotiya Chandan S., Chauhan Amit, Yadav Anju: Chemical investigation of the essential oil of Laggera crispata (Vahl) Hepper & Wood from India. In: Journal of the Serbian Chemical Society. 76. Jahrgang, Nr. 4, 2011, S. 523–528, doi:10.2298/JSC100801048V.
- ↑ MS Owolabi, Lajide L, Villanueva HE, Setzer WN: Essential oil composition and insecticidal activity of Blumea perrottetiana growing in southwestern Nigeria. In: Natural Product Communications. 5. Jahrgang, Nr. 7, 2010, S. 1135–1138, PMID 20734958.
- ↑ Nurhayat Tabanca, Ulrich R. Bernier, Maia Tsikolia, James J. Becnel, Blair Sampson, Chris Werle, Betül Demirci, Kemal Hüsnü Can Ba, Eugene K. Blythe, Cecil Pounders, David E. Wedge: Eupatorium capillifolium Essential Oil: Chemical Composition, Antifungal Activity, and Insecticidal Activity. In: Natural Product Communications. 5. Jahrgang, Nr. 9, 2010, S. 1409–1415 (unl.edu [abgerufen am 19. Januar 2017]).
- ↑ Pran N. Kaul, Bhaskaruni R. Rajeswara Rao, Arun K. Bhattacharya, Kamla Singh, Gopal R. Mallavarapu, S. Ramesh: Essential Oil Composition of Sphaeranthus indicus L. In: Journal of Essential Oil Research. 17. Jahrgang, Nr. 4, 2005, doi:10.1080/10412905.2005.9698961.
- ↑ Stéphane Andreani: Chemical Variability and Antioxidant Activity of Limbarda crithmoides L. Essential Oil from Corsica. In: Chemistry & Biodiversity. 10. Jahrgang, Nr. 11, 2013, S. 2061–2077, doi:10.1002/cbdv.201300109.
- ↑ Hakim Aliou: Chemical composition and antifungal activity of Bubonium imbricatum volatile oil. In: Phytopathologia Mediterranea. 47. Jahrgang, Nr. 1, 2008, S. 3–10, doi:10.14601/Phytopathol_Mediterr-2541.
- ↑ Bjora C. Soderberg & Shari L. Fields: EXPEDIENT SYNTHESES OF ESPINTANOL, p-METHOXYCARVACROL AND THYMOQUINOL DIMETHYL ETHER. In: Organic Preparations and Procedures International. Band 28, Nr. 2, 1996, S. 221–225, doi:10.1080/00304949609356526.