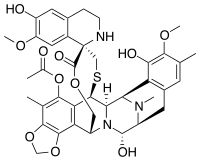
Ecteinascidin 743
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Ecteinascidin 743 | |||||||||
| Summenformel | C39H43N3O11S | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code | ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 761,84 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Ecteinascidin 743 (auch Trabectedin oder ET-743) ist ein Chemotherapeutikum zur Behandlung von Weichteilsarkomen und Eierstockkrebs. Es wird auch in klinischen Studien auf die Eignung für die Behandlung von Brust- und Prostatasarkomen untersucht.
Entdeckung
Im Jahr 1969 wurde im Rahmen eines großangelegten Untersuchungsprogramms des National Cancer Institutes von Inhaltsstoffen von Pflanzen und Meereslebewesen entdeckt, dass ein Extrakt der Seescheide Ecteinascidia turbinata antikarzinogene Eigenschaften aufwies. Die Charakterisierung der aktiven Komponente Ecteinascidin 743 erfolgte jedoch erst im Jahr 1984 durch Kenneth L. Rinehart an der University of Illinois.[2] Die Struktur von Ecteinascidin 743 ist komplex und weist drei Tetrahydroisochinolin-Einheiten, 8 Ringe, darunter ein zehngliedriger heterocyclischer Ring mit einem Cystein-Rest und sieben chiralen Zentren auf. Die Wirkung von Ecteinascidin 743 beruht auf der Bindung an die Desoxyribonukleinsäure und einer Störung des Zellzyklus.
Synthese
Nachdem Versuche zur Züchtung der Seescheide fehlschlugen und die Ausbeute nur im ppm-Bereich lag, wurde die Arbeitsgruppe von E. J. Corey mit der Synthese des Naturstoffs beauftragt. Der Syntheseweg wurde 1996 veröffentlicht.[3] Eine vereinfachte Synthese wurde später ebenfalls in Coreys Gruppe entwickelt.[4]
Es wird angenommen, dass die Biosynthese von Ecteinascidin 743 die Dimerisierung von zwei Tyrosinresten beinhaltet, um den pentacyclischen Kern des Moleküls zu bilden. Die Synthesestrategie der Totalsynthese von E. J. Corey war inspiriert von der vorgeschlagenen Biosyntheseroute. Die Synthese nutzt solche Reaktionen wie die Mannich-Reaktion, die Pictet-Spengler-Reaktion, die Curtius-Umlagerung und eine durch einen chirale Diphosphan-Rhodiumkomplex katalysierte enantioselektive Hydrierung.
Ein anderer Syntheseweg verläuft über die Ugi-Reaktion, einer Ein-Topf-Mehrkomponentenreaktion, die für die Synthese eines komplexen Moleküls eher ungewöhnlich ist.[5]
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Kenneth L. Rinehart: Antitumor compounds from tunicates. In: Medicinal Research Reviews. 20, 2000, S. 1–27, doi:10.1002/(SICI)1098-1128(200001)20:1<1::AID-MED1>3.0.CO;2-A.
- ↑ E. J. Corey, David Y. Gin, Robert S. Kania: Enantioselective Total Synthesis of Ecteinascidin 743. In: Journal of the American Chemical Society. 118, 1996, S. 9202–9203, doi:10.1021/ja962480t.
- ↑ Eduardo J. Martinez, E. J. Corey: A New, More Efficient, and Effective Process for the Synthesis of a Key Pentacyclic Intermediate for Production of Ecteinascidin and Phthalascidin Antitumor Agents. In: Organic Letters. 2, 2000, S. 993–996, doi:10.1021/ol0056729.
- ↑ Atsushi Endo, Arata Yanagisawa, Masanao Abe, Shigemitsu Tohma, Toshiyuki Kan, Tohru Fukuyama: Total Synthesis of Ecteinascidin 743. In: Journal of the American Chemical Society. 124, 2002, S. 6552–6554, doi:10.1021/ja026216d.