Optogenetik
Die Optogenetik ist eine biologische Technologie, um zelluläre Aktivität mit Licht kontrollieren zu können. Dazu werden Fremdgene in die Zielzellen eingeschleust, die zur Expression lichtempfindlicher Ionenkanäle, Transporter oder Enzyme führen. Im weiteren Sinne werden auch fluoreszierende Proteine zu den optogenetischen Werkzeugen gerechnet, die es erlauben, zelluläre Aktivität mit Licht zu messen. Die optogenetische Kontrolle der Aktivität von Nervenzellen hat bereits zu zahlreichen neuen Erkenntnissen über die Funktion neuronaler Schaltkreise geführt.[1]
Geschichte und Protagonisten[Bearbeiten | Quelltext bearbeiten]
Grundlage für diese Forschungsrichtung war die Entdeckung von Rhodopsin in Bakterien (Bacteriorhodopsin) Anfang der 1970er Jahre durch Dieter Oesterhelt, der 2021 dafür von der Lasker Foundation einen Preis bekam.[2]
Als führende Entwickler des Forschungszweiges der Optogenetik gelten Karl Deisseroth[3] und seine ehemaligen Mitarbeiter Edward Boyden[4] und Feng Zhang[5]. Der entscheidende Durchbruch gelang durch die Entdeckung, dass sich lichtgesteuerte Kanäle aus einer Alge in Zellen anderer Organismen einbauen lassen und diese dadurch lichtempfindlich machen. Georg Nagel und Peter Hegemann veröffentlichten diese Entdeckung 2002[6] und 2003[7] und schickten ihr fluoreszenzmarkiertes genetisches Werkzeug an die Arbeitsgruppen von Karl Deisseroth, Roger Tsien und Alexander Gottschalk[8]. Zu den Wegbereitern der Optogenetik avant la lettre werden auch Gero Miesenböck und Boris Zemelman mit ihren Forschungen aus den Jahren 2002[9] und 2003[10] gerechnet.[11] Die Optogenetik wurde von der Zeitschrift Nature Methods zur Methode des Jahres 2010 gekürt.[12] Die Pioniere der Optogenetik wurden 2013 mit dem Brain Prize ausgezeichnet.
2020 wurde der Mediziner Botond Roska für seine Forschung auf dem Gebiet der Optogenetik mit dem Körber-Preis ausgezeichnet. Er untersucht, wie geschädigte Netzhäute mit Gentherapie geheilt werden können. 2021 gelang es einem internationalen Forschungsteam erstmals, einem durch Retinitis pigmentosa erblindeten 58-jährigen Patienten mit einer optogenetischen Therapie partiell das Sehen wieder zu ermöglichen.[13]
Beschreibung[Bearbeiten | Quelltext bearbeiten]
Es handelt sich bei dieser Technologie um eine Kombination von Methoden der Optik und der Genetik, mit dem Ziel, bestimmte funktionelle Ereignisse in spezifischen Zellen oder lebenden Geweben an- (gain-of-function) oder abzuschalten (loss-of-function). Hierbei werden lichtempfindliche Proteine auf gentechnischem Wege durch Manipulation der codierenden DNA (d. h. des entsprechenden Gens) verändert und anschließend in bestimmte Zielzellen bzw. -gewebe eingebracht. Unter Lichteinfluss ist es anschließend möglich, das Verhalten der in dieser Weise modifizierten Zellen zu kontrollieren.
Die Optogenetik erlaubt also eine gezielte und überaus schnelle (Millisekundenbereich) Kontrolle von exakt definierten Ereignissen in komplexen biologischen Systemen.[14] Möglich werden hierdurch Untersuchungen auf Proteinebene (Anwendungen in der Molekularbiologie), auf Ebene von einzelnen Zellen (Zellbiologie) und definierten Geweben (Histologie) oder sogar auf Ebene von sich frei bewegenden Säugetieren (Verhaltensbiologie).
Die von der Wissenschaftszeitschrift Nature Methods zur „Methode des Jahres 2010“ erkorene Technologie wird in Tiermodellen für Parkinson und Epilepsie erprobt.[14][15][16]
Optogenetische Verfahren werden heute schon genutzt, um unterschiedliche intrazelluläre Prozesse, wie z. B. die Lokalisation von Proteinen in bestimmten Regionen der Zelle oder die Produktion spezifischer Moleküle wie Second Messenger (sekundäre Botenstoffe), zu erforschen bzw. zu kontrollieren.[17] Durch diese gezielte Modifizierung der zellulären Signalkaskaden erfährt die Zellbiologie derzeit einen Erkenntniszuwachs über intrazelluläre Abläufe, wie er noch vor einigen Jahren kaum vorstellbar war. Auch in der Neurobiologie, wo das Verfahren erstmals entwickelt wurde, ermöglicht es bislang undenkbar detaillierte Einblicke in die Arbeitsweise des Nervensystems und des Gehirns.[15][18]
Channelrhodopsin als Beispiel für einen optogenetischen Schalter[Bearbeiten | Quelltext bearbeiten]
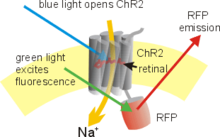
Ein Beispiel, wie die Optogenetik auf molekularer Ebene eingesetzt wird, ist die Verwendung einer genetisch modifizierten Form des Channelrhodopsins (ChR2) als „Schalter“-Molekül. Channelrhodopsine sind von Natur aus eigenständige, lichtgesteuerte Ionenkanäle. Sie sind trotz struktureller Verwandtheit keine so genannten G-Protein-gekoppelten Rezeptoren. Es ist nun möglich, das in den Intrazellularraum hineinreichende C-terminale Ende des ChR2-Proteins zu ersetzen oder zu verändern (modifizieren), ohne dass die Funktion des Proteins als Ionenkanal beeinträchtigt wird. Die genetisch modifizierten Fusions-Proteine können anschließend mit Hilfe einer Reihe von Transfektionstechniken (virale Transfektion, Elektroporation, Genkanone) in erregbaren Zellen wie Neuronen eingebracht und dort zur Expression (Produktion) gebracht werden. Vitamin A, die Vorstufe des lichtabsorbierenden Chromophors Retinal, ist in Wirbeltier-Zellen meist schon vorhanden, so dass sich erregbare Zellen, die ein Channelrhodopsin exprimieren, durch Beleuchtung einfach depolarisieren lassen. Dies erlaubt wiederum den Einsatz von modifizierten Channelrhodopsinen, beispielsweise für Anwendungen wie die Photostimulation von Neuronen. Das blauempfindliche ChR2 in Kombination mit der durch Gelblicht-aktivierbaren Chlorid-Pumpe Halorhodopsin erlauben das An- und Abschalten der neuronalen Aktivität innerhalb von Millisekunden.[19]
Wird ChR2 mit einem Fluoreszenzlabel markiert, können durch Licht angeregte Axone und Synapsen im intakten Gehirngewebe identifiziert werden.[20] Diese Technik lässt sich zur Aufklärung der molekularen Ereignisse während der Induktion synaptischer Plastizität einsetzen.[21] Mit Hilfe von ChR2 wurden weitreichende neuronale Bahnen im Gehirn kartiert.[22] Dass sich das Verhalten transgener Tiere, die ChR2 in einem Anteil ihrer Neuronen exprimieren, durch intensive Beleuchtung mit Blaulicht berührungslos kontrollieren lässt, wurde bereits für Nematoden, Taufliegen, Zebrafische und Mäuse gezeigt.[23][24] Eine überraschende Entdeckung war, dass sich durch gezielte Mutationen die Ionenselektivität von ChR2 von Kationen (Na+, K+) auf Anionen (Cl-) umstellen lässt.[25] Anionen-leitende Channelrhodopsine werden verwendet, um neuronale Aktivität mit Licht zu unterdrücken.[26][27]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Edward Boyden und T. Knopfel (Hrsg.): Optogenetics: Tools for Controlling and Monitoring Neuronal Activity (= Progress in Brain Research, Band 196), Elsevier, Amsterdam 2012. (Link zum kostenfreien ersten Kapitel: A comprehensive concept of optogenetics)
- [1] The Brain Prize 2013 jointly awarded to Ernst Bamberg, Edward Boyden, Karl Deisseroth, Peter Hegemann, Gero Miesenböck and Georg Nagel for ‘…their invention and refinement of optogenetics. …’
- Optogenetik – Chancen in der Anwendung, BT-Drs. 19/9084
- Sébastien Tremblay et al., An Open Resource for Non-human Primate Optogenetics, Neuron, Volume 108, Issue 6, 2020, Pages 1075-1090.e6, https://doi.org/10.1016/j.neuron.2020.09.027.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Licht ist besser! Interview mit Peter Hegemann
- Channelrhodopsin mediating optical activation of neurons (englisch)
- Von den Lichtrezeptoren einzelliger Algen zur lichtgesteuerten Maus (allgemeinverständliche Vorlesung)
- Optogenetics: Method of the Year 2010
- Neue Möglichkeiten durch Optogenetik. Studiogespräch mit Peter Hegemann
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Lief Fenno, Ofer Yizhar, Karl Deisseroth: The Development and Application of Optogenetics. In: Annual Review of Neuroscience. Band 34, Nr. 1, 21. Juli 2011, ISSN 0147-006X, S. 389–412, doi:10.1146/annurev-neuro-061010-113817, PMID 21692661, PMC 6699620 (freier Volltext). The Development and Application of Optogenetics (Memento vom 5. Februar 2020 im Internet Archive)
- ↑ Yannick Ramsel: Man muss offen bleiben für den Zufall. Interview mit Dieter Oesterhelt. In: Die Zeit Nr. 40 vom 30. September 2021, S. 41
- ↑ Kerri Smith: Method man: Karl Deisseroth is leaving his mark on brain science one technique at a time, in: Nature, Band 497 vom 30. Mai 2013, S. 550.
- ↑ Millisecond-timescale, genetically targeted optical control of neural activity.Nat Neurosci 8, 1263–1268 (2005). Boyden, E.S., Zhang, F., Bamberg, E., Nagel, G. & Deisseroth, K. Nat Neurosci 8, 1263–1268 (2005).
- ↑ Kerry Grens: Feng Zhang: The Midas of Methods. in: The Scientist Magazine.
- ↑ Georg Nagel, Doris Ollig, Markus Fuhrmann, Suneel Kateriya, Anna Maria Musti, Ernst Bamberg, Peter Hegemann: Channelrhodopsin-1: A Light-Gated Proton Channel in Green Algae. In: Science. Band 296, Nr. 5577, 28. Juni 2002, ISSN 0036-8075, S. 2395–2398, doi:10.1126/science.1072068, PMID 12089443 (sciencemag.org [abgerufen am 18. August 2017]).
- ↑ Georg Nagel, Tanjef Szellas, Wolfram Huhn, Suneel Kateriya, Nona Adeishvili, Peter Berthold, Doris Ollig, Peter Hegemann, Ernst Bamberg: Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. In: Proceedings of the National Academy of Sciences. Band 100, Nr. 24, 25. November 2003, ISSN 0027-8424, S. 13940–13945, doi:10.1073/pnas.1936192100, PMID 14615590 (pnas.org [abgerufen am 18. August 2017]).
- ↑ Georg Nagel, Martin Brauner, Jana F. Liewald, Nona Adeishvili, Ernst Bamberg, Alexander Gottschalk: Light Activation of Channelrhodopsin-2 in Excitable Cells of Caenorhabditis elegans Triggers Rapid Behavioral Responses. In: Current Biology. Band 15, Nr. 24, S. 2279–2284, doi:10.1016/j.cub.2005.11.032 (elsevier.com [abgerufen am 18. August 2017]).
- ↑ Boris V. Zemelman, Georgia A. Lee, Minna Ng und Gero Miesenböck: Selective Photostimulation of Genetically ChARGed Neurons, in: Neuron, Band 33, Nr. 1 vom 3. Januar 2002, S. 15–22.
- ↑ Boris V. Zemelman, Nasri Nesnan, Georgia A. Lee und Gero Miesenböck: Photochemical gating of heterologous ion channels: Remote control over genetically designated populations of neurons (Memento vom 2. Dezember 2020 im Internet Archive), in: PNAS, Band 100, Nr. 3 (2003), S. 1352–1357.
- ↑ Lief Fenno, Ofer Yizhar und Karl Deisseroth: The Development and Application of Optogenetics, in: Annual Review of Neuroscience, Band 34 (2011), S. 389–412, hier S. 390f.
- ↑ Anonym: Method of the Year 2010. In: Nature Methods. 8, 2010, S. 1–1, doi:10.1038/nmeth.f.321.
- ↑ Optogenetische Gentherapie lässt Erblindeten partiell wieder Sehen. 24. Mai 2021, abgerufen am 28. Mai 2021 (deutsch).
- ↑ a b Karl Deisseroth: Optogenetics. In: Nature Methods. Band 8, Nr. 1, 2011, S. 26–29, doi:10.1038/nmeth.f.324, PMID 21191368.
- ↑ a b Im Licht der Zellen. Zeit Online, abgerufen am 26. Januar 2011.
- ↑ Special Feature: Method of the Year 2010. Nature, abgerufen am 26. Januar 2011.
- ↑ Jared E Toettcher, Christopher A Voigt, Orion D Weiner, Wendell A Lim: The promise of optogenetics in cell biology: interrogating molecular circuits in space and time. In: Nature Methods. Band 8, Nr. 1, 2011, S. 35–38, doi:10.1038/nmeth.f.326, PMID 21191368.
- ↑ Silvana Konermann, Mark D. Brigham u. a.: Optical control of mammalian endogenous transcription and epigenetic states. In: Nature. 2013, S. , doi:10.1038/nature12466.
- ↑ Feng Zhang, Li-Ping Wang, Martin Brauner, Jana F. Liewald, Kenneth Kay, Natalie Watzke, Phillip G. Wood, Ernst Bamberg, Georg Nagel, Alexander Gottschalk, Karl Deisseroth: Multimodal fast optical interrogation of neural circuitry. In: Nature. Band 446, Nr. 7136, 5. März 2007, S. 633–639, doi:10.1038/nature05744, PMID 17410168.
- ↑ Yan-Ping Zhang, Thomas G Oertner: Optical induction of synaptic plasticity using a light-sensitive channel. In: Nat Meth. Band 4, Nr. 2, Januar 2007, S. 139–141, doi:10.1038/nmeth988, PMID 17195846.
- ↑ Yan-Ping Zhang, Niklaus Holbro, Thomas G. Oertner: Optical induction of plasticity at single synapses reveals input-specific accumulation of αCaMKII. In: Proceedings of the National Academy of Sciences. Band 105, Nr. 33, 2008, S. 12039–12044, doi:10.1073/pnas.0802940105, PMID 18697934.
- ↑ Leopoldo Petreanu, Daniel Huber, Aleksander Sobczyk, Karel Svoboda: Channelrhodopsin-2-assisted circuit mapping of long-range callosal projections. In: Nat Neurosci. Band 10, Nr. 5, 15. April 2007, S. 663–668, doi:10.1038/nn1891, PMID 17435752.
- ↑ Adam D. Douglass, Sebastian Kraves, Karl Deisseroth, Alexander F. Schier, Florian Engert: Escape Behavior Elicited by Single, Channelrhodopsin-2-Evoked Spikes in Zebrafish Somatosensory Neurons. In: Current Biology. Band 18, Nr. 15, 5. Juli 2008, S. 1133–1137, doi:10.1016/j.cub.2008.06.077, PMID 18682213.
- ↑ Daniel Huber, Leopoldo Petreanu, Nima Ghitani, Sachin Ranade, Tomas Hromadka, Zach Mainen, Karel Svoboda: Sparse optical microstimulation in barrel cortex drives learned behaviour in freely moving mice. In: Nature. Band 451, Nr. 7174, 3. Januar 2008, S. 61–64, doi:10.1038/nature06445, PMID 18094685.
- ↑ J. Wietek, J. S. Wiegert, N. Adeishvili, F. Schneider, H. Watanabe: Conversion of Channelrhodopsin into a Light-Gated Chloride Channel. In: Science. Band 344, Nr. 6182, 25. April 2014, ISSN 0036-8075, S. 409–412, doi:10.1126/science.1249375.
- ↑ Jonas Wietek, Riccardo Beltramo, Massimo Scanziani, Peter Hegemann, Thomas G. Oertner: An improved chloride-conducting channelrhodopsin for light-induced inhibition of neuronal activity in vivo. In: Scientific Reports. Band 5, Nr. 1, 7. Oktober 2015, ISSN 2045-2322, doi:10.1038/srep14807.
- ↑ Naoya Takahashi, Thomas G. Oertner, Peter Hegemann, Matthew E. Larkum: Active cortical dendrites modulate perception. In: Science. Band 354, Nr. 6319, 23. Dezember 2016, ISSN 0036-8075, S. 1587–1590, doi:10.1126/science.aah6066.