Tetraphenylporphyrin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetraphenylporphyrin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C44H30N4 | ||||||||||||||||||
| Kurzbeschreibung |
violetter Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 614,74 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,244 g/cm3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Tetraphenylporphyrin, abgekürzt TPP oder 2HTPP, ist ein synthetischer heterocyclischer Stoff, der natürlich vorkommenden Porphyrinen ähnelt. Porphyrine sind Farbstoffe und Cofaktoren, die in Hämoglobin und Cytochromen vorkommen und Chlorophyll und Vitamin B12 ähneln. Tetraphenylporphyrin ist ein hydrophober violetter Feststoff, der symmetrisch substituiert, einfach zu synthetisieren und in nichtpolaren organischen Lösemitteln wie Chloroform und Benzen löslich ist.
Synthese und Struktur[Bearbeiten | Quelltext bearbeiten]
Tetraphenylporphyrin wurde zuerst 1935 von Rothemund synthetisiert, indem er Pyrrol mit Benzaldehyd im Bombenrohr bei 150 °C reagieren ließ. Die Reaktionsdauer betrug hierbei 24 h und die Ausbeute war nie höher als etwa 10 %.[4] 1967 entwickelten Adler und Longo eine effektivere Synthese, indem sie Pyrrol und Benzaldehyd in Propionsäure als Lösungsmittel reagieren ließen. Hierbei betrug die Reaktionszeit ca. 30 min und es konnten Ausbeuten von über 20 % erzielt werden:[5]
Trotz der geringen Ausbeute wird diese Synthese häufig zu Lehrzwecken in Universitäten durchgeführt.[6][7]
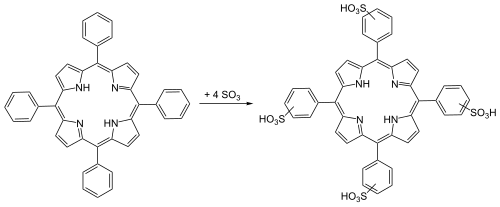
TPP gehört zu der Symmetriegruppe D2h.[8] Die geringe Symmetrie wird durch die aus der Ebene der Pyrrolringe herausragenden N-H-Bindungen verursacht. Im Gegensatz zu natürlichen Porphyrinen ist H2TPP an den oxidationsempfindlicheren Kohlenstoffen substituiert. Dieses Substitutionsmuster wird auch als meso-Porphyrin bezeichnet.[9] H2TPP kann sulfoniert werden, um wasserlösliche Derivate zu erhalten:
Optische Eigenschaften[Bearbeiten | Quelltext bearbeiten]

Tetraphenylporphyrin hat ein starkes Absorptionsmaximum bei 419 nm (die sogenannte Soret-Bande) und vier kleinere Maxima bei 515 nm, 550 nm, 593 nm und 649 nm. Es zeigt eine rote Fluoreszenz mit einem Maximum bei 649 nm und 717 nm. Die Quantenausbeute liegt bei 11 %.[10]
Anwendungen[Bearbeiten | Quelltext bearbeiten]
Tetraphenylporphyrin sowie seine Derivate können als Liganden für Schwermetallkationen fungieren. Die auf diese Weise hergestellten Komplexe haben teilweise interessante Eigenschaften und können z. B. in der Histologie als Färbemittel verwendet werden. Tetraphenylporphyrin selbst kann als Photosensibilisator bei der Darstellung von Singulett-Sauerstoff verwendet werden.[11] Es kann auch an Stelle des cancerogenen Cobalt(II)-chlorids in Kombination mit Magnesiumchlorid und Silica Gel als Feuchtigkeits-Indikator verwendet werden.[12]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Datenblatt meso-Tetraphenylporphine, low chlorine bei Alfa Aesar, abgerufen am 25. Mai 2017 (Seite nicht mehr abrufbar).
- ↑ Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons. William Andrew, 2008, ISBN 0-8155-1990-7, S. 294 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Datenblatt meso-Tetraphenylporphine (PDF) bei Strem, abgerufen am 25. Mai 2017.
- ↑ P. Rothemund: A New Porphyrin Synthesis. The Synthesis of Porphin. In: J. Am. Chem. Soc. 58. Jahrgang, Nr. 4, 1936, S. 625–627, doi:10.1021/ja01295a027.
- ↑ A. D. Adler, F. R. Longo, J. D. Finarelli, J. Goldmacher, J. Assour and L. Korsakoff: A simplified synthesis for meso-tetraphenylporphine. In: J. Org. Chem. 32. Jahrgang, Nr. 2, 1967, S. 476–476, doi:10.1021/jo01288a053.
- ↑ Falvo, RaeAnne E.; Mink, Larry M.; Marsh, Diane F.: Microscale Synthesis and 1H NMR Analysis of Tetraphenylporphyrins. In: J. Chem. Educ. 1999. Jahrgang, Nr. 76, S. 237, doi:10.1021/ed076p237.
- ↑ Girolami, G. S.; Rauchfuss, T. B.; Angelici, R. J., Synthesis and Technique in Inorganic Chemistry, University Science Books: Mill Valley, CA, 1999, ISBN 0-935702-48-2.
- ↑ D. Marsh, L. Mink, J. Chem. Educ. 1996, 73, 1188.
- ↑ Ji-Young Shin, Hiroyuki Furuta, Kenji Yoza, Shinetsu Igarashi, Atsuhiro Osuka: m eso -Aryl-Substituted Expanded Porphyrins. In: Journal of the American Chemical Society. Band 123, Nr. 29, Juli 2001, S. 7190–7191, doi:10.1021/ja0106624.
- ↑ J. B. Kim, J. J. Leonard and F. R. Longo: A mechanistic study of the synthesis and spectral properties of meso-tetraphenylporphyrin. In: J. Am. Chem. Soc. 94. Jahrgang, Nr. 11, 1972, S. 3986–3992, doi:10.1021/ja00766a056.
- ↑ Karl-Heinz Pfoertner "Photochemistry" in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a19_573
- ↑ Yoshiyuki Fueda, Jin Matsumoto, Tsutomu Shiragami, Kazunori Nobuhara, Masahide Yasuda: Porphyrin/MgCl2/Silica Gel Composite as a Cobalt-free Humidity Indicator. In: Chemistry Letters. Band 36, Nr. 10, 2007, S. 1246–1247, doi:10.1246/cl.2007.1246.