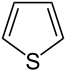
Thiophen
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Thiophen | ||||||||||||||||||
| Andere Namen |
Thiofuran | ||||||||||||||||||
| Summenformel | C4H4S | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit schwach benzolartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 84,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,06 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
84 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Dipolmoment | |||||||||||||||||||
| Brechungsindex |
1,5289[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
80,2 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Thiophen, auch Thiofuran genannt, ist eine organische Verbindung mit der Summenformel C4H4S und zählt zu den Heteroaromaten. Vier Kohlenstoffatome und ein Schwefelatom bilden einen Fünfring mit sechs π-Elektronen, vier stammen von den Doppelbindungen und zwei von einem freien Elektronenpaar des Schwefels.
Tritt ein Thiophenring als Substituent auf, so wird dies mit dem Präfix Thienyl- angegeben. Als Anelland heißt er Thieno.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Thiophen wurde 1883 von Victor Meyer in Rohbenzol entdeckt, das durch Destillation von Steinkohlenteer gewonnen wurde. Während „phen“ auf das gasförmige Kokereiprodukt „Leuchtgas“ hinweisen sollte, das damals als Stadtgas zur Beleuchtung (gr. phainomei: leuchten) in den Städten diente, leitet sich „Thio“ vom Schwefel (gr. theion, vgl. auch Thioether) ab.
Das von Victor Meyer verwendete Rohbenzol bildete mit Isatin einen blauen Farbstoff, wenn es mit Schwefelsäure versetzt wurde (Indophenin-Reaktion). Daher hielt man die Bildung des Indophenins lange Zeit für eine Reaktion mit Benzol, bis ein Versuch mit reinem Benzol keine Farbreaktion ergab.[5]
Hugo Erdmann und Jacob Volhard gelang die Thiophensynthese in der die nach beiden benannten Volhard-Erdmann-Zyklisierung.
Herstellung[Bearbeiten | Quelltext bearbeiten]
Technisch wird Thiophen aus Butan und Schwefel bei 560 °C synthetisiert:[6]
Statt Butan können auch Derivate des Butans, wie Butene, Butadien oder 1-Butanol eingesetzt werden, als Schwefelspender auch beispielsweise Schwefeldioxid oder Schwefelkohlenstoff.[2]
Weiterhin kann Thiophen durch Erhitzen von Natriumsuccinat mit Diphosphortrisulfid oder durch Überleiten von Acetylen über erhitzten Pyrit erhalten werden.[2]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Thiophen ist bei Raumtemperatur eine mit Wasser nicht mischbare Flüssigkeit, die benzolartig riecht und bei 84 °C siedet.
Da es sich um eine aromatische Verbindung handelt, unterscheiden sich seine Eigenschaften stark von denen konventioneller Thioether: So ist es beispielsweise nicht möglich, den Schwefel mittels Methyliodid zu alkylieren, während die diesen flankierenden CH-Gruppen empfänglich für einen elektrophilen Angriff sind. Da es sich mit Schwefelsäure leicht sulfonieren lässt, ist die Umwandlung in die wasserlösliche Thiophensulfonsäure die Basis für Abscheidung von Thiophen aus verunreinigtem Benzol. Eine Trennung des Benzol-Thiophen-Gemisches durch Destillation ist aufgrund der sich um nur 4 °C unterscheidenden Siedepunkte kaum möglich.
Sicherheitstechnische Kenngrößen[Bearbeiten | Quelltext bearbeiten]
Thiophen bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von −9 °C.[1][7] Der Explosionsbereich liegt zwischen 1,5 Vol.‑% (52 g/m3) als untere Explosionsgrenze (UEG) und 12,5 Vol.‑% (435 g/m3) als obere Explosionsgrenze (OEG).[1][7] Der maximale Explosionsdruck beträgt 8,4 bar.[1][7] Die Grenzspaltweite wurde mit 0,91 mm (50 °C) bestimmt.[1][7] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA.[1][7] Die Zündtemperatur beträgt 395 °C.[1][7] Der Stoff fällt somit in die Temperaturklasse T2.
Polythiophen[Bearbeiten | Quelltext bearbeiten]
Polythiophene (PT) können durch elektrochemische Polymerisation von Thiophen oder dessen Derivate hergestellt werden. Auch ist die Herstellung aus Grignard-Verbindungen von 2,5-Dihalogenthiophenen[2] oder durch Oxidation möglich. Polythiophene sind höchst stabil gegenüber Wärme, Sauerstoff oder Feuchtigkeit.
Undotiertes Polythiophen besitzt nur eine geringe Leitfähigkeit. Durch Dotieren mit geeigneten Oxidationsmitteln werden jedoch Leitfähigkeiten bis 100 S/cm erreicht. Daher finden dotierte Polythiophene als Elektrodenmaterial, Halbleiter und Lichtemitter in Organischen Leuchtdioden Verwendung.[2] Die Polythiophene leuchten bei Anlegung einer Spannung, wobei die jeweilige Farbe mit der elektrischen Spannung variiert werden kann. Da unsubstituiertes Polythiophen unlöslich und unschmelzbar ist, werden zur besseren Verarbeitung PT-Derivate benutzt.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Thiophen ist wie Benzol im Steinkohlenteer enthalten und kann auch als Verunreinigung in diesem enthalten sein.
Siehe auch[Bearbeiten | Quelltext bearbeiten]
- Ersetzt man formal den Schwefel des Thiophens durch Sauerstoff, so erhält man die strukturanaloge Verbindung Furan.
- Ersetzt man formal das Schwefelatom durch Selen, so erhält man Selenophen.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Eintrag zu Thiophen. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j k l m n o p Eintrag zu Thiophen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Februar 2018. (JavaScript erforderlich)
- ↑ a b c d e f g Eintrag zu Thiophen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. April 2014.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-58.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ Victor Meyer: Über den Begleiter des Benzols im Steinkohlenteer
- ↑ Beyer-Walter Lehrbuch der Organischen Chemie, 23. Auflage, S. Hirzel Verlag 1998.
- ↑ a b c d e f E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.


