Zinknitrid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ N3− _ Zn2+ | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Zinknitrid | ||||||||||||
| Andere Namen |
Trizinkdinitrid | ||||||||||||
| Verhältnisformel | Zn3N2 | ||||||||||||
| Kurzbeschreibung |
schwarzgrauer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 224,2 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
6,22 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
löslich in Salzsäure und Natriumhydroxid unter Ammoniakbildung[2] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Zinknitrid ist eine anorganische chemische Verbindung des Zinks aus der Gruppe der Nitride. Sie wurde 1940 erstmals von R. Juza und H. Hahn synthetisiert.[4]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Zinknitrid kann durch Reaktion von Zink oder Zinkoxid mit Ammoniak gewonnen werden.[1][5]
Ebenfalls möglich ist die Herstellung durch Reaktion von Zink mit Stickstoff bei 600 °C.[5]
Eigenschaften
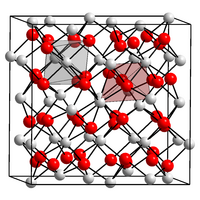
[Bearbeiten | Quelltext bearbeiten]Zinknitrid ist ein schwarzgrauer, an Luft weitgehend beständiger Feststoff. Er besitzt eine kubische Kristallstruktur.[1][2] Diese ist isostrukturell zu der von Magnesiumnitrid, Calciumnitrid und Cadmiumnitrid eine Anti-Bixbyit-Struktur mit der Raumgruppe Ia3 (Raumgruppen-Nr. 206) und dem Gitterparameter a = 9,7691 Å. Die Kristallstruktur ist ein Derivat der von Calciumfluorid, wobei Stickstoff und Zink-Atome die Position des Calciums und drei Viertel der Fluor-Positionen einnehmen. In dieser kubischen Struktur besetzen Zink-Atome die Tetraederlücken einer etwa kubisch gepackte Anordnung von Stickstoff-Atomen.[4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1031.
- ↑ a b c Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch Fur Chemiker Und Physiker. Springer DE, 1998, ISBN 3-642-58842-5, S. 810 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt Zinc Nitride bei Alfa Aesar, abgerufen am 8. Mai 2013 (Seite nicht mehr abrufbar).
- ↑ a b J. G. Zhao, L. X. Yang, S. J. You, F. Y. Li, C. Q. Jin, J. Liu: Structural stability of Zn3N2 under high pressure. In: Physica B: Condensed Matter. Band 405, Nr. 7, April 2010, S. 1836–1838, doi:10.1016/j.physb.2010.01.057.
- ↑ a b R. K. Sharma: Chemistry Of Hydrides And Carbides. Discovery Publishing House, 2007, ISBN 81-8356-227-2, S. 313 (eingeschränkte Vorschau in der Google-Buchsuche).



