2-Cyclohexen-1-on
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | 2-Cyclohexen-1-on | |||||||||
| Andere Namen |
Cyclohex-2-enon | |||||||||
| Summenformel | C6H8O | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 96,13 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
0,99 g·cm−3 (20 °C)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
167–169 °C[1] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit |
löslich in Wasser[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
2-Cyclohexen-1-on ist im reinen Zustand eine farblose, aber als kommerziell erhältliches Produkt meist gelbliche Flüssigkeit. Bezüglich seiner funktionellen Gruppen kann man es sowohl zu den Cycloalkenen als auch zu den Ketonen zählen.
Gewinnung und Darstellung
Zur Herstellung von 2-Cyclohexen-1-on gibt es mehrere verschiedene Synthesewege, von denen nur einige hier genannt seien:
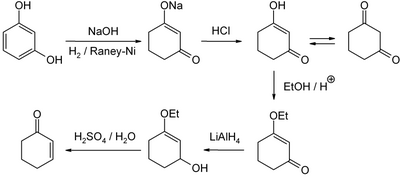
Eine für den Labormaßstab gut ausgearbeitete Methode ist die Reduktion und saure Hydrolyse von 3-Ethoxy-2-cyclohexen-1-on, welches wiederum aus Resorcin über das 1,3-Cyclohexandion zugänglich ist:
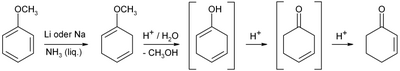
Steht flüssiges Ammoniak zur Verfügung, ist es ausgehend von Anisol durch Birch-Reduktion mit anschließender saurer Hydrolyse und Umlagerung der C–C-Doppelbindung erhältlich:
Ebenfalls recht gut ist es aus Cyclohexanon durch α-Bromierung und Eliminierung, oder aus 3-Chlorcyclohexen mittels Hydrolyse und Oxidation erhältlich.
Technisch wird 2-Cyclohexen-1-on durch katalytische Oxidation von Cyclohexen, z. B. mit Wasserstoffperoxid an Vanadiumkatalysatoren, hergestellt. Es sind mehrere Verfahrensvarianten mit unterschiedlichen Oxidationsmitteln bzw. Katalysatoren patentiert.
Eigenschaften
Physikalische Eigenschaften
2-Cyclohexen-1-on ist mit einem Schmelzpunkt von −53 °C und einem Siedepunkt von etwa 170 °C bei Raumtemperatur eine leichtbewegliche, klare Flüssigkeit, die mit 0,993 g·cm−3 eine Dichte ähnlich der von Wasser aufweist.
Es ist mit vielen Lösungsmitteln, wie z. B. Alkoholen (Methanol, Ethanol), Ethern (Diethylether, Tetrahydrofuran, 1,4-Dioxan, tert-Butylmethylether), Halogenalkanen (Dichlormethan, Chloroform), Estern (Ethylacetat) und auch mit polaren, aprotischen Lösungsmitteln (N,N-Dimethylformamid, Dimethylsulfoxid) unbegrenzt mischbar.
Die Löslichkeit in Wasser beträgt 41,3 g·l−1 bei pH 7 und 25 °C.
Chemische Eigenschaften
2-Cyclohexen-1-on kann sowohl übliche Reaktionen von Ketonen (z. B. Acetalbildung) als auch von Alkenen (z. B. elektrophile Additionen, Cycloadditionen, Epoxidierung) eingehen. Als typischer Vertreter der α,β-ungesättigten Carbonylverbindungen besitzt es eine elektronenarme C–C-Doppelbindung, die auch als Elektrophil fungieren kann. Mit starken Basen kann es an den Positionen 4 und 6 (die beiden CH2-Gruppen, die der Carbonylgruppe bzw. der C–C-Doppelbindung benachbart sind) deprotoniert werden.
Verwendung
Es ist ein oft verwendeter Synthesebaustein in der organischen Chemie, da es viele verschiedene Möglichkeiten der Molekülgerüst-Erweiterungen bietet. Beispielsweise kann es leicht in einer Michael-Addition mit Nukleophilen (wie etwa Enolaten oder Silylenolethern) oder auch im Sinne einer Diels-Alder-Reaktion mit elektronenreichen Dienen umgesetzt werden. Weiterhin reagiert es mit Organokupfer-Verbindungen unter 1,4-Addition (Michael-Addition) oder mit Grignard-Verbindungen unter 1,2-Addition, d. h. mit Angriff des Nukleophils am Carbonyl-Kohlenstoffatom. Es wird z. B. in mehrstufigen Totalsynthesen beim Aufbau von polycyclischen Naturstoffen eingesetzt.
Einzelnachweise
- ↑ a b c d e f g Datenblatt 2-Cyclohexen-1-on bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ a b c Datenblatt 2-Cyclohexen-1-on bei Merck
Literatur
- W. F. Gannon, H. O. House, Organic Synthesis, Coll. Vol. 5, 1973, S. 294.
- W. F. Gannon, H. O. House, Organic Synthesis, Coll. Vol. 5, 1973, S. 539.
- R. B. Thompson, Organic Synthesis, Coll. Vol. 3, 1955, S. 278.