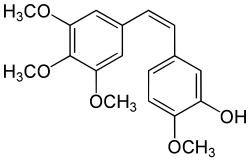
Combretastatin A-4
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Combretastatin A-4 | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C18H20O5 | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 316,35 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Löslichkeit |
löslich in DMSO (>10 g·l−1)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Combretastatin A-4 ist ein Naturstoff aus der Gruppe der Stilbene. Erstmals entdeckt und isoliert wurde es aus Combretum caffrum, einer Art von südafrikanischen Langfäden.
Vorkommen
Natürliche Combretastatine kommen im afrikanischen Baum Combretum caffrum vor.[2] Pflanzen synthetisieren Combretastatin und andere Stilbene als Abwehrstoffe über den Shikimisäureweg über Phenylalanin und Malonyl-CoA. Der letzte Schritt der Biosynthese wird durch das Enzym Stilbensynthase katalysiert.[3] Chemisch gesehen handelt es sich um Stilbenoide, da sich die Strukturen von Stilben (1,2‑Diphenylethen) ableiten. Es gibt mehrere natürlich vorkommende Derivate, der bekannteste und biologisch aktivste Vertreter ist das Combretastatin A-4. Für pharmazeutische Formulierungen ist die geringe Wasserlöslichkeit von 350 µM[4] ein Nachteil.
Wirkung
Combretastatin A-4 ist ähnlich wie das Alkaloid Colchicin ein Inhibitor der Tubulin-Polymerisation, das Mikrotubuli destabilisiert und in eine Tasche zwischen der α- und β-Untereinheit von Tubulin bindet.[5] Diese Tasche wird daher in der Literatur als „colchicine binding site“ bezeichnet. Derzeit (2019) befindet sich Fosbretabulin, ein Phosphorsäureester von Combretastatin A-4, aufgrund seiner Antitumor-Aktivität in einer Phase II klinischen Studie.[6] In Laborversuchen konnte auch eine Wirkung von Combretastatin A-4 gegen Dengue- und Zika-Viren gezeigt werden.[7]
Einzelnachweise
- ↑ a b c d e Datenblatt Combretastatin A4, ≥98% (HPLC), powder bei Sigma-Aldrich, abgerufen am 11. Dezember 2019 (PDF).
- ↑ G. R. Pettit, S. B. Singh, E. Hamel, C. M. Lin, D. S. Alberts: Isolation and structure of the strong cell growth and tubulin inhibitor combretastatin A-4. In: Experientia. Band 45, Nr. 2, Februar 1989, S. 209–211, doi:10.1007/BF01954881.
- ↑ Philippe Jeandet, Bertrand Delaunois, Alexandra Conreux, David Donnez, Vitale Nuzzo: Biosynthesis, metabolism, molecular engineering, and biological functions of stilbene phytoalexins in plants. In: BioFactors. Band 36, Nr. 5, 2010, S. 331–341, doi:10.1002/biof.108.
- ↑ Lauren Lee, Lyda M. Robb, Megan Lee, Ryan Davis, Hilary Mackay: Design, Synthesis, and Biological Evaluations of 2,5-Diaryl-2,3-dihydro-1,3,4-oxadiazoline Analogs of Combretastatin-A4. In: Journal of Medicinal Chemistry. Band 53, Nr. 1, 14. Januar 2010, S. 325–334, doi:10.1021/jm901268n, PMID 19894742, PMC 2810428 (freier Volltext).
- ↑ Roberto Gaspari, Andrea E. Prota, Katja Bargsten, Andrea Cavalli, Michel O. Steinmetz: Structural Basis of cis- and trans-Combretastatin Binding to Tubulin. In: Chem. Band 2, Nr. 1, 12. Januar 2017, S. 102–113, doi:10.1016/j.chempr.2016.12.005.
- ↑ Karol Jaroch, Maciej Karolak, Przemysław Górski, Alina Jaroch, Adrian Krajewski: Combretastatins: In vitro structure-activity relationship, mode of action and current clinical status. In: Pharmacological Reports. Band 68, Nr. 6, 1. Dezember 2016, S. 1266–1275, doi:10.1016/j.pharep.2016.08.007.
- ↑ Michael Richter, Mila M. Leuthold, Dominik Graf, Ralf Bartenschlager, Christian D. Klein: Prodrug Activation by a Viral Protease: Evaluating Combretastatin Peptide Hybrids To Selectively Target Infected Cells. In: ACS Medicinal Chemistry Letters. Band 10, Nr. 8, 8. August 2019, S. 1115–1121, doi:10.1021/acsmedchemlett.9b00058, PMID 31413794, PMC 6691480 (freier Volltext).

