Kleptoplastid
Kleptochloroplasten oder Kleptoplastiden sind Chloroplasten, die von Organismen aufgenommen werden und vorübergehend photosynthetisch genutzt (Mixotrophie) oder ggf. später bei Nahrungsmangel verdaut werden. Sie werden im Gegensatz zu den Plastiden der Grünalgen und höheren Pflanzen, die ihre Plastiden durch Endosymbiose erlangt haben, nicht an die Nachkommen weitergegeben. Die Kleptoplastiden haben gewöhnlich eine Lebensdauer von nur wenigen Tagen und werden dann ersetzt.[1][2] Die Art der Verwendung und die Stabilität der aufgenommenen Chloroplasten variiert jedoch stark zwischen den Organismengruppen.
Die selektive Erhaltung der Kleptoplastiden wird im Rahmen der Endosymbiontentheorie benutzt, um die Entstehung der Chloroplasten aus ursprünglich freilebenden Cyanobakterien, Cryptophyten oder Haptophyten zu erklären.[3]
Wimpertierchen
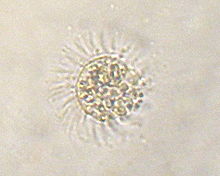
Mesodinium rubrum (alias Myrionecta rubra) ist ein Wimpertierchen, das die rötlich-gelben (phycobilinhaltigen) Chloroplasten (und Mitochondrien) von Cryptophyceen der Art Geminigera cryophila raubt.[4][5][6][6] M. rubrum ist selbst Opfer von Kleptoplastie, wenn es zur Beute von Dinoflagellaten der Gattung Dinophysis wird.[7][6]
Wimpertierchen der Gattung Strombidium rauben Chloroplasten der Alge Ulva.[8] Bei der Spezies S. oculatum (nach WoRMS ein Synonym von S. tintinnodes [9]) hat man Kleptoplastidie von Augenflecken gefunden,[10][11] siehe Augenfleck §Strombidium.
Dinoflagellaten
Bei Einzellige phototrophe Dinoflagellaten der Gattungen Dinophysis und Amylax wurden Plastiden gefunden, die von Cryptophyceen stammen, insbesondere von Teleaulax amphioxeia und Geminigera cryophila.[12] Zumindest im ersten Fall handelt es sich um ein Beispiel „sekundärer“ Kleptoplastidie: Die Kleptoplasten mixotropher Wimpertierchen der Gattung Mesodinium (M. rubrum) können zur Beute heterotropher Arten der Gattung Dinophysis (wie D. acuminata und D. acuta) werden. Diese Dinophysis-Arten nutzen die phycobilinhaltigen Chloroplasten ihrer Wimpertierchen-Beute, die aber selbst schon Kleptoplasten sind. Die Mesodinium-Wimpertierchen ernähren sich bereits ihrerseits von Cryptophyceen (aus dem Geminigera/Plagioselmis/Teleaulax-Komplex),[13] wobei sie deren Plastiden und Mitochondrien beibehalten.[6][14][15][16][17] Es handelt sich deshalb nicht um eine gewöhnliche Endosymbiose, da offenbar nur der Chloroplast der Cryptophyceen ohne Nucleomorph und die äußeren beiden Membranen aufgenommen wird, so dass nur ein zweilagiger Chloroplast zurückbleibt. Um auf Dauer überlebensfähig zu sein und sich reproduzieren zu können, ist es für die Cryptophyceen-Chloroplasten aber erforderlich, dass ihr Nucleomorph erhalten bleibt. In Zellkultur isoliert gezüchtete Dinophysis-Spezies können nicht überleben. Es erscheint daher möglich (wenn auch noch nicht bestätigt), dass der Dinophysis-Chloroplast ein Kleptoplastid ist. Das würde bedeuten, dass die Dinophysis-Chloroplasten mit der Zeit verschleißen und die Dinophysis-Einzeller ständig neue Cryptophyten aufnehmen müssen, um verbrauchte Chloroplasten durch neue zu ersetzen.[18] Die Dinophysyis-Kleptoplasten können immerhin bis zu zwei Monate lang überdauern. In anderen Dinoflagellaten wie Gymnodinium spp. und Pfiesteria piscicida[19] sind die Kleptoplasten nur wenige Tage photosynthetisch aktiv.[20][21] Ein weiterer Vertreter der Dinoflagellaten, der Kleptroplastidie betreibt, ist Shimiella gracilenta.[22]
Karyokleptie
Karyokleptie ist ein verwandter Prozess, bei dem auch Zellkerne der Beute zeitweilig erhalten bleiben. Dies wurde erstmals ebenfalls bei Myrionecta rubra beschrieben.[23]
Foraminiferen
Einige Kammerlinge (Foraminifera) der Gattungen Bulimina, Elphidium, Haynesina, Nonion, Nonionella, Nonionellina, Reophax, Stainforthia und anderer rauben Chloroplasten von Diatomeen.[24] Im Gegensatz enthalten manche Foraminiferen photosynthetisch aktive Dinoflagellaten (Zooxanthellen) als Endosymbionten.
Meeresschnecken




C = Chloroplast,
N = Zellkern (Nukleus).
Elektronenmikroskopische Aufnahme: Maßstab 3 µm.
Eine Reihe von Schlundsackschnecken (Sacoglossa) grasen Algen (beispielsweise verschiedene Arten von Caulerpa) auf dem Meeresboden ab, wobei sie deren Chloroplasten aufnehmen und in ihre Haut einlagern.[25] Die höchste beobachtete Stabilität der aufgenommenen Chloroplasten zeigen die Kleptochloroplasten der kräftig grün gefärbten Meeresschnecke Elysia chlorotica. Das Tier nimmt die Alge Vaucheria litorea auf, verdaut den Großteil des Zellkörpers und integriert die Plastiden durch Phagozytose in die Epithelzellen ihres Verdauungstraktes.[26] Das Organell exprimiert sogar weiterhin plastidäre Gene. Im Aquarium überlebt die Schnecke ohne Nahrung, nur durch Zufuhr von Licht acht bis neun Monate, was auch der typischen Lebensdauer in freier Wildbahn entspricht.[27][28][29] Einige der Gene aus den Zellkernen der Nahrung wurden sogar auf die Schnecken übertragen, weshalb die Chloroplasten mit für sie lebenswichtigen Proteinen versorgt werden können.[30][31] Einigen Arten von Elysia erlaubt die Kleptoplastidie, sich selbst zu enthaupten und aus dem Kopfteil wieder einen vollständigen Körper zu regenerieren (beobachtet 2021 bei Elysia cf. marginata und E. atroviridis).[32]
Auch andere Schnecken der Familien Elysioidea, Conchoidea und Stiligeroidea können auf diese Art Chloroplasten aufnehmen, jedoch wird die Stabilität der Kleptoplasten von E. chlorotica mit etwa 10 Monaten soweit bekannt nirgends anders erreicht.[33]
Schlundsackschnecken (Sacoglossa) des Pazifiks können ebenfalls Chloroplasten aus Algen aufnehmen und lagern diese in ihre Mitteldarmdrüse oder ihre Haut ein. Einige andere Meeresschnecken fressen Korallen, die ihrerseits Photosynthese treibende Algen tragen.
Gegenbeispiele
Ein Reihe von Tieren nehmen photosynthetisch aktive Mikroalgen oder Dinoflagellaten (so genannte Zooxanthellen) als Endosymbionten auf. Diese Einzeller bleiben als Ganzes intakt. Beispielsweise leben einige Arten der Nacktkiemer (Nudibranchia) in Symbiose mit solchen Zooxanthellen, die sich in ihren Verdauungs-Divertikeln befinden; sie sind also ebenfalls ‚solar angetrieben`.[34] Auch Steinkorallen leben in Symbiose mit Zooxanthellen, deren Verlust zur Korallenbleiche und dem Absterben der Korallen führen kann.
Die Grüne Hydra (Hydrozoa) lebt ebenfalls in Symbiose mit aufgenommenen Algen. Gleiches gilt für manche Acoelomorpha z. B. die Gattung Waminoa, die ebenfalls Symbiosealgen bzw. Zooxanthellen besitzen und sich unter anderem (aber nicht ausschließlich) von deren Photosyntheseprodukten ernähren.[35] Symsagittifera und auch Convoluta (beide Convolutidae) leben in Symbiose mit der einzelligen Grünalge Tetraselmis convolutae.[36]
Zusammenfassung
Die Gegenbeispiele zeigen, dass äußerlich – etwa an der grünen Farbe eines Meerestieres – nicht zu erkennen ist, ob Kleptoplastidie oder Symbiose vorliegt. Die Schlundsackschnecken sind somit die einzigen bekannten Tiere (Metazoa), bei denen echte Kleptoplastidie beobachtet wird.[37] Der Übergang ist jedoch fließend, wie das Beispiel Elysia zeigt.
Siehe auch
Literatur
- Aditee Mitra: Meeresbiologie – Das Beste aus zwei Welten. In: Spektrum der Wissenschaft. April 2019, S. 54–60.
- Neue Räuber-Kategorie: Kleptoprädatoren. auf: wissenschaft.de vom 1. November 2017.
- Trevor J. Willis u. a.: Kleptopredation: a mechanism to facilitate planktivory in a benthic mollusc. In: Biology Letters. 1. November 2017, doi:10.1098/rsbl.2017.0447. (Dies ist ein verwandtes Verhalten, insbesondere bei Dinophysis)
Einzelnachweise
- ↑ Alf Skovgaard: Role of chloroplast retention in a marine dinoflagellate. In: Aquatic Microbial Ecology. Band 15, 1998, S. 293–301, doi:10.3354/ame015293.
- ↑ Richard G. Dorrell, Christopher J. Howe: Integration of plastids with their hosts: Lessons learned from dinoflagellates. In: Proceedings of the National Academy of Sciences. Band 112, Nr. 33, 18. August 2015, ISSN 0027-8424, S. 10247–10254, doi:10.1073/pnas.1421380112, PMID 25995366, PMC 4547248 (freier Volltext), bibcode:2015PNAS..11210247D (englisch, Online).
- ↑ Charles F. Delwiche: Tracing the Thread of Plastid Diversity Through the Tapestry of Life. In: The American Naturalist. Vol. 154, Supplement: Evolutionary Relationships Among Eukaryotes, Oktober 1999, S. S164–S177, doi:10.1086/303291.
- ↑ Matthew D. Johnson, David Oldach, F. Delwiche Charles, Diane K. Stoecker: Retention of transcriptionally active cryptophyte nuclei by the ciliate Myrionecta rubra. In: Nature. Band 445, Nr. 7126, Januar 2007, S. 426–428, doi:10.1038/nature05496, PMID 17251979.
- ↑ A. Mitra: Meeresbiologie – Das Beste aus zwei Welten. 2019, S. 54–56.
- ↑ a b c d María García-Portela, Beatriz Reguera, Manoella Sibat, Andreas Altenburger, Francisco Rodríguez, Philipp Hess: Metabolomic Profiles of Dinophysis acuminata and Dinophysis acuta Using Non-Targeted High-Resolution Mass Spectrometry: Effect of Nutritional Status and Prey, in: MDPI Marine Drugs, Band 16, Nr. 15, 143, 26. April 2018, doi:10.3390/md16050143, PMID 29701702, PMC 5982093 (freier Volltext).
- ↑ G. Nishitani, S. Nagai, K. Baba, S. Kiyokawa, Y. Kosaka, K. Miyamura, T. Nishikawa, K. Sakurada, A. Shinada, T. Kamiyama: High-level congruence of Myrionecta rubra prey and Dinophysis species plastid identities as revealed by genetic analyses of isolates from Japanese coastal waters. In: Applied and Environmental Microbiology. Band 76, Nr. 9, 2010, S. 2791–2798, doi:10.1128/AEM.02566-09, PMID 20305031, PMC 2863437 (freier Volltext).
- ↑ A. Mitra: Meeresbiologie – Das Beste aus zwei Welten. 2019, S. 57.
- ↑ Strombidium oculatum Gruber, 1884. auf: World Register of Marine Species (WoRMS)
- ↑ David J. S. Montagnes, Chris D. Lowe, Alex Poulton, Per R. Jonsson: Redescription of Strombidium oculatum Gruber 1884 (Ciliophora, Oligotrichia). In: The Journal of Eukaryotic Microbiology. 12. Juli 2015, doi:10.1111/j.1550-7408.2002.tb00379.x
- ↑ E. Fauré-Fremiet: The Origin of the Metazoa and the Stigma of the Phytoflagellates. In: Journal of Cell Science. s3-99, 1958, S. 123–129; PDF1 @paperity
- ↑ Jong Im Kim, Hwan Su Yoon, Gangman Yi, Hyung Seop Kim, Wonho Yih, Woongghi Shin: The Plastid Genome of the Cryptomonad Teleaulax amphioxeia. In: PLOS ONE, Band 10, Nr. 6, 52015, e0129284, doi:10.1371/journal.pone.0129284, PMC 4457928 (freier Volltext), PMID 26047475.
- ↑ Cryptomonads. In: Tree of Life Project. 2. April 2010, abgerufen am 7. Dezember 2021.
- ↑ A. Mitra: Meeresbiologie – Das Beste aus zwei Welten. 2019, S. 54f und 57.
- ↑ Patrick J. Keeling: Diversity and evolutionary history of plastids and their hosts. In: American Journal of Botany. Band 91, Nr. 10, 2004, S. 1481–1493, doi:10.3732/ajb.91.10.1481, PMID 21652304.
- ↑ Jacques Joyard, Maryse A. Block, Roland Douce: Molecular aspects of plastid envelope biochemistry. In: Eur. J. Biochem. Band 199, Nr. 3, 1991, S. 489–509, doi:10.1111/j.1432-1033.1991.tb16148.x, PMID 1868841.
- ↑ Kiyotaka Takishitaa, Kazuhiko Koikeb, Tadashi Maruyamaa, Takehiko Ogatab: Molecular Evidence for Plastid Robbery (Kleptoplastidy) in Dinophysis, a Dinoflagellate causing Diarrhetic Shellfish Poisoning. In: Protist. 2002, Vol. 153, S. 293–302. PMID 12389818.
- ↑ Jeremiah D. Hackett, Donald M. Anderson, Deana L. Erdner, Debashish Bhattacharya: Dinoflagellates: A remarkable evolutionary experiment. In: American Journal of Botany. Band 91, Nr. 10, 2004, S. 1523–1534, doi:10.3732/ajb.91.10.1523, PMID 21652307.
- ↑ JoAnn M. Burkholder: Eine 'Giftalge' mit vielen Tarnkappen, Spektrum.de vom 1. Januar 2000.
- ↑ R. J. Gast, D. M. Moran, M. R. Dennett, D. A. Caron: Kleptoplasty in an Antarctic dinoflagellate: caught in evolutionary transition? In: Environ. Microbiol. Band 9, Nr. 1, Januar 2007, S. 39–45, doi:10.1111/j.1462-2920.2006.01109.x, PMID 17227410.
- ↑ S. Minnhagen, W. F. Carvalho, P. S. Salomon, S. Janson: Chloroplast DNA content in Dinophysis (Dinophyceae) from different cell cycle stages is consistent with kleptoplasty. In: Environ. Microbiol. Band 10, Nr. 9, September 2008, S. 2411–2417, doi:10.1111/j.1462-2920.2008.01666.x, PMID 18518896.
- ↑ Jin Hee Ok, Hae Jin Jeong, Sung Yeon Lee, Sang Ah Park, Jae Hoon Noh: Shimiella gen. nov. And Shimiella gracilenta sp. nov. (Dinophyceae, Kareniaceae), a Kleptoplastidic Dinoflagellate From Korean Waters And Its Survival Under Starvation, in: J. Phycol., Band 57, 2021, S. 70–91, doi:10.1111/jpy.13067-20-0057.
- ↑ Matthew D. Johnson, David Oldach u. a.: Retention of transcriptionally active cryptophyte nuclei by the ciliate Myrionecta rubra. In: Nature. Band 445, Nr. 7126, 25. Januar 2007, S. 426–428, doi:10.1038/nature05496, PMID 17251979 (Online).
- ↑ Joan M. Bernhard, Samuel S. Bowser: Benthic foraminifera of dysoxic sediments: chloroplast sequestration and functional morphology. In: Earth-Science Reviews. Band 46, Nr. 1-4, 1999, S. 149–165, doi:10.1016/S0012-8252(99)00017-3.
- ↑ S. I. Williams uns D. I. Walker: Mesoherbivore-macroalgal interactions: feeding ecology of sacoglossan sea slugs (Mollusca, Opisthobranchia) and their effects on their food algae. Oceanography and Marine Biology: an Annual Review 1999, 37, S. 87–128. Abstract.
- ↑ Catherine Brahic: Solar-powered sea slug harnesses stolen plant genes. In: New Scientist. 24. November 2008, abgerufen am 6. April 2019.
- ↑ C. C. Mujer, D. L. Andrews et al.: Chloroplast genes are expressed during intracellular symbiotic association of Vaucheria litorea with the sea slug Elysia chlorotica. In: Proc Natl Acad Sci USA. Band 93, Nr. 22, 29. Oktober 1996, S. 12333–12338, doi:10.1073/pnas.93.22.12333
- ↑ M. E. Rumpho, E. J. Summer, J. R. Manhart: Solar-powered sea slugs. Mollusc/algal chloroplast symbiosis. In: Plant Physiology. Band 123, Nr. 1, Mai 2000, S. 29–38, doi:10.1104/pp.123.1.29, PMID 10806222, PMC 1539252 (freier Volltext).
- ↑ L. Muscatine, R. W. Greene: Chloroplasts and algae as symbionts in molluscs. In: International Review of Cytology. Band 36, 1973, ISBN 0-12-364336-8, S. 137–169, doi:10.1016/S0074-7696(08)60217-X. PMID 4587388
- ↑ SymBio: Introduction-Kleptoplasty. University of Maine, archiviert vom (nicht mehr online verfügbar) am 2. Dezember 2008; abgerufen am 6. April 2019.
- ↑ M. E. Rumpho, J. M. Worful, J. Lee, K. Kannan, M. S. Tyler, D. Bhattacharya, A. Moustafa, J. R. Manhart: Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug Elysia chlorotica. In: Proceedings of the National Academy of Sciences of the United States of America. Band 105, Nr. 46, November 2008, S. 17867–17871, doi:10.1073/pnas.0804968105, PMID 19004808, PMC 2584685 (freier Volltext), bibcode:2008PNAS..10517867R.
- ↑ Sayaka Mitoh, Yoichi Yusa: Extreme autotomy and whole-body regeneration in photosynthetic sea slugs. In: Current Biology. Band 31, Nr. 5, 8. März 2021, S. PR233–R234 doi:10.1016/j.cub.2021.01.014. Dazu:
- Michelle Starr: These Self-Decapitating Sea Slugs Can Grow an Entire New Body on The Old Head, auf: sciencealert, 8. März 2021 (englisch)
- Martin Vieweg: Skurril: Körper-Regeneration nach Selbst-Enthauptung, auf: wissenschaft.de vom 8. März 2021 (deutsch)
- ↑ S. K. Pierce, S. E. Massey, J. J. Hanten, N. E. Curtis: Horizontal Transfer of Functional Nuclear Genes Between Multicellular Organisms. In: Biol. Bull. Band 204, Nr. 3, 1. Juni 2003, S. 237–240, doi:10.2307/1543594, PMID 12807700., JSTOR 1543594
- ↑ D. C. Sutton, O. Hoegh-Guldberg: Host-Zooxanthella Interactions in Four Temperate Marine Symbioses; Assessment of Effect of Host Extract on Symbionts. In: The Biological bulletin, Marine Biological Laboratory (Woods Hole, Mass.), Band 178, 1990, S. 175.
- ↑ Piera Biondi, Giovanni Diego Masucci, Shiori Kunihiro, James Davis Reimer: Distribution of the flatworm Waminoa spp. on the west coast of Okinawa, Japan.; Konferenz Japanese Coral Reef Society, Dezember 2016; doi:10.13140/RG.2.2.18466.02243, ResearchGate.
- ↑ A. E. Douglas: Establishment of the symbiosis in Convoluta roscoffensis. In: Journal of the marine Biological association, Band 63, Nr. 2, Mai 1983, S. 409–418. doi:10.1017/S0025315400070776, Epub 16. Oktober 2009.
- ↑ K. Händeler, Y. P. Grzymbowski, P. J. Krug, H. Wägele: Functional chloroplasts in metazoan cells - a unique evolutionary strategy in animal life. In: Frontiers in Zoology. Band 6, 1. Dezember 2009, S. 28; doi:10.1186/1742-9994-6-28.