Benutzer:Roland1952/Formeln/Archiv/2010/März
Helium
- Archivierung dieses Abschnittes wurde gewünscht von: -- Roland1952DiskBew. 00:33, 25. Mär. 2010 (CET)
Ribonukleotidreduktase#Mechanismus_der_Reduktion
- Archivierung dieses Abschnittes wurde gewünscht von: -- Roland1952DiskBew. 00:35, 25. Mär. 2010 (CET)
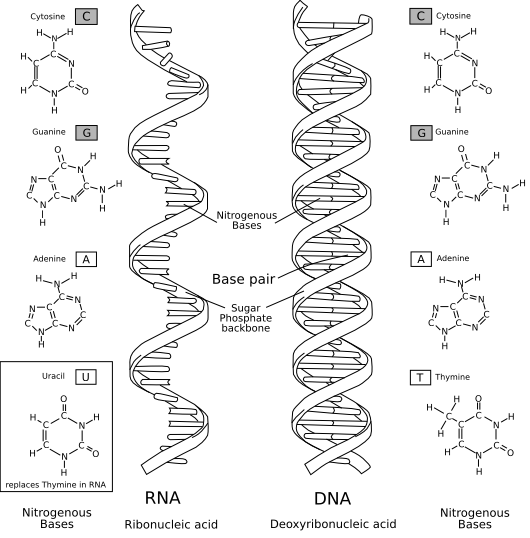
Ribonukleinsäure#Aufbau und Unterschied zur DNA
Einverstanden?-- Roland1952DiskBew. 00:01, 14. Mär. 2010 (CET)
- im artikel eingebaut und nach Commons. -- Roland1952DiskBew. 14:28, 14. Mär. 2010 (CET)
- Sorry für die späte Antwort. Alles in allem finde ich's gut. Wie schon auf der Bilderwunsch-Seite angemerkt, würde ich eine bestehende DNA-Vorlage verwenden: Datei:DNA structure and bases.svg. Zudem sollten IMHO die Abkürzungen „DNA“ und „RNA“ verwendet werden. --Leyo 18:01, 14. Mär. 2010 (CET)
- Meintest du jetzt, dass die Basenpaare beschriftet sein sollten? Und mMn DNA mit DNA zu übersetzen ist „gerglish“ oder „denglisch“. Gruß -- Roland1952DiskBew. 18:37, 14. Mär. 2010 (CET)
- Nein, ich meinte nur die Form der Helix. Betreffend DNA und RNA: siehe WP:RLC :-) --Leyo 18:41, 14. Mär. 2010 (CET)
- Dass die Drehrichtung verkehrt ist? Die RNA muss nach links drehen, wie im englischen Bild? -- Roland1952DiskBew. 18:55, 14. Mär. 2010 (CET)?
- Nein, das meinte ich nicht und kann ich gerade nicht beantworten. Du hast die Helix zwar viel besser hingekriegt als ich es hätte. Dennoch finde ich die Version in der Ursprungsgrafik (die ja fast gleich ist wie in der verlinkten SVG-Grafik) noch etwas schöner. --Leyo 09:57, 16. Mär. 2010 (CET)
- Dass die Drehrichtung verkehrt ist? Die RNA muss nach links drehen, wie im englischen Bild? -- Roland1952DiskBew. 18:55, 14. Mär. 2010 (CET)?
- Nein, ich meinte nur die Form der Helix. Betreffend DNA und RNA: siehe WP:RLC :-) --Leyo 18:41, 14. Mär. 2010 (CET)
- Meintest du jetzt, dass die Basenpaare beschriftet sein sollten? Und mMn DNA mit DNA zu übersetzen ist „gerglish“ oder „denglisch“. Gruß -- Roland1952DiskBew. 18:37, 14. Mär. 2010 (CET)
- Sorry für die späte Antwort. Alles in allem finde ich's gut. Wie schon auf der Bilderwunsch-Seite angemerkt, würde ich eine bestehende DNA-Vorlage verwenden: Datei:DNA structure and bases.svg. Zudem sollten IMHO die Abkürzungen „DNA“ und „RNA“ verwendet werden. --Leyo 18:01, 14. Mär. 2010 (CET)
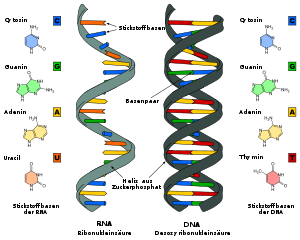
- Ich habe mal Leyos Vorschlag aufgegriffen und unter dem Namen Difference_DNA_RNA-DE.svg eine Alternative auf Commons hochgeladen. Viele Grüße, --Sponk 20:08, 22. Mär. 2010 (CET)
- Hallo Sponk, kannst du noch die Farben zu den entsprechenden Strukturformeln in den beiden Bildern im Artikel noch abgleichen? Gruß -- Roland1952DiskBew. 18:08, 24. Mär. 2010 (CET)
- Hallo Roland! Ich nehme an Du meinst dieses Bild, oder? Du hast natürlich recht, dass es didaktisch sicherlich sinnvoller ist, wenn die Farben der beiden Abbildungen aufeinander abgeglichen sind. Ich werde Deinen Vorschlag in den nächsten Tagen – evtl. aber erst am Wochenende – in Angriff nehmen! Danke und viele Grüße, --Sponk 22:28, 24. Mär. 2010 (CET)
- Genau das meinte ich. Alles Gute -- Roland1952DiskBew. 00:18, 25. Mär. 2010 (CET)
- Ich habe eine neue Version erstellt und eingebunden. (Dabei habe ich übrigens auch gerade eine DNA-Variante hochgeladen...) Viele Grüße, --Sponk 20:25, 25. Mär. 2010 (CET)
- Sehr gut, danke schön. Damit hier wohl
- Ich habe eine neue Version erstellt und eingebunden. (Dabei habe ich übrigens auch gerade eine DNA-Variante hochgeladen...) Viele Grüße, --Sponk 20:25, 25. Mär. 2010 (CET)
- Hallo Sponk, kannst du noch die Farben zu den entsprechenden Strukturformeln in den beiden Bildern im Artikel noch abgleichen? Gruß -- Roland1952DiskBew. 18:08, 24. Mär. 2010 (CET)
- Ich habe mal Leyos Vorschlag aufgegriffen und unter dem Namen Difference_DNA_RNA-DE.svg eine Alternative auf Commons hochgeladen. Viele Grüße, --Sponk 20:08, 22. Mär. 2010 (CET)
- Archivierung dieses Abschnittes wurde gewünscht von: -- Roland1952DiskBew. 20:35, 25. Mär. 2010 (CET)
Satratoxine
-
Satratoxin F
-
Satratoxin G
-
Satratoxin H
-
Satratoxin H aus Artikel
Hallo Roland, folgende Anmerkungen/Wünsche hätte ich noch (nur zur Erläuterung: mir liegt die Originalliteratur nicht vor!):
- Beiden hier gezeigten Molekülen fehlt die Stereochemie im unteren Molekülteil.
- Das aktuell im Artikel verwendetete Sat H hat leider eine andere räumliche Orientierung, was den Vergleich der drei Verbindungen erschwert. Könntest Du dieses dann nochmals in der hier verwendeten Orientierung zeichnen?
- Im Sat F sind noch die Reste R und R1. Entweder sollten wir die in R1 und R2 umbenennen, besser aber vielleicht die tatsächlichen Reste zeichnen - oder
- ist es sinnvoll die R's zu behalten, weil damit eine Zeichnung für mehrere Satratoxine verwendet werden kann? (Für was stehen dann die beiden R?)
Danke schon mal --Mabschaaf 11:12, 19. Mär. 2010 (CET)
- Hallo Mabschaaf, vielen Dank erst Mal für die Info. Kümmer ich mich im Laufe des Tages darum. Gruß-- Roland1952DiskBew. 12:32, 19. Mär. 2010 (CET)
- Die Satratoxine G und F habe ich so aus der Literatur nachgezeichnet. Das Satratoxin H aus dem Artikel nachgezeichnet und einfach um 180° gedreht. Ob die Stereochemie jetzt noch stimmt, weiß ich nicht (Vollkeile gegen Strichkeile austauschen?). Wenn ich den unteren Sechserring bei „meinem“ Sartratoxin H noch eindrehen soll, einfach Bescheid geben, ändere dann gerne. Wenn ich das mit meinem laienhaften Verstand richtig sehe, scheinen sich die Sartoxine G und H nur in der Stereochemie zu unterscheiden, aber wie??? Kann man die Bilder in der Galerie vergrößern und wie? Alles Gute -- Roland1952DiskBew. 14:38, 19. Mär. 2010 (CET)
- Laut der Summenformel im Artikel hat Sat-G ein O-Atom mehr als Sat-H. Und ja, ich würde bevorzugen, den unteren Ring auch noch so auszurichten, dass er den anderen Molekülen entspricht. Das obere Ringsystem ist im rechten Teil auch noch anders dargestellt als bei Sat-F und Sat-G. --Mabschaaf 14:56, 19. Mär. 2010 (CET)
- Orci, kannst du bitte anhand der Literatur nachsehen, ob ich die Namen den Strukturen richtig zugewiesen habe, da die Abbildungen unbeschriftet sind. Davon hängt dann mMn die weitere vorgehensweise ab. Gruß -- Roland1952DiskBew. 16:18, 19. Mär. 2010 (CET)
- Etwas kompliziert: die obere Struktur in der Literatur (mit der Doppelbindung, von Dir als "G" bezeichnet) ist Sat. H. Das ist die einzige der drei Sat., die an dieser Stelle eine Doppelbindung hat, die anderen beiden haben ein Epoxid (wenn man sich ein bisschen mit NMR auskennt, kann man das auch an den angeg. NMR-Verschiebungen erkennen). F und G unterscheiden sich nur in den Resten R1 (R ist immer ein H-Atom): bei F ist das ein Acetylrest, bei G der gleiche wie bei H (2-Hydroxy-Ethyl). Viele Grüße --Orci Disk 16:59, 19. Mär. 2010 (CET)
- Ich hoffe, Orci, dich richtig verstanden zu haben und habe entsprechend die Strukturformeln angepasst. Falls nicht, sage bitte bescheid. Gruß -- Roland1952DiskBew. 01:05, 20. Mär. 2010 (CET)
- Etwas kompliziert: die obere Struktur in der Literatur (mit der Doppelbindung, von Dir als "G" bezeichnet) ist Sat. H. Das ist die einzige der drei Sat., die an dieser Stelle eine Doppelbindung hat, die anderen beiden haben ein Epoxid (wenn man sich ein bisschen mit NMR auskennt, kann man das auch an den angeg. NMR-Verschiebungen erkennen). F und G unterscheiden sich nur in den Resten R1 (R ist immer ein H-Atom): bei F ist das ein Acetylrest, bei G der gleiche wie bei H (2-Hydroxy-Ethyl). Viele Grüße --Orci Disk 16:59, 19. Mär. 2010 (CET)
- Orci, kannst du bitte anhand der Literatur nachsehen, ob ich die Namen den Strukturen richtig zugewiesen habe, da die Abbildungen unbeschriftet sind. Davon hängt dann mMn die weitere vorgehensweise ab. Gruß -- Roland1952DiskBew. 16:18, 19. Mär. 2010 (CET)
- Laut der Summenformel im Artikel hat Sat-G ein O-Atom mehr als Sat-H. Und ja, ich würde bevorzugen, den unteren Ring auch noch so auszurichten, dass er den anderen Molekülen entspricht. Das obere Ringsystem ist im rechten Teil auch noch anders dargestellt als bei Sat-F und Sat-G. --Mabschaaf 14:56, 19. Mär. 2010 (CET)
- Die Satratoxine G und F habe ich so aus der Literatur nachgezeichnet. Das Satratoxin H aus dem Artikel nachgezeichnet und einfach um 180° gedreht. Ob die Stereochemie jetzt noch stimmt, weiß ich nicht (Vollkeile gegen Strichkeile austauschen?). Wenn ich den unteren Sechserring bei „meinem“ Sartratoxin H noch eindrehen soll, einfach Bescheid geben, ändere dann gerne. Wenn ich das mit meinem laienhaften Verstand richtig sehe, scheinen sich die Sartoxine G und H nur in der Stereochemie zu unterscheiden, aber wie??? Kann man die Bilder in der Galerie vergrößern und wie? Alles Gute -- Roland1952DiskBew. 14:38, 19. Mär. 2010 (CET)
Eingebaut und damit erledigt. Vielen Dank! --Mabschaaf 17:32, 28. Mär. 2010 (CEST)
- Archivierung dieses Abschnittes wurde gewünscht von: -- Roland1952DiskBew. 00:06, 1. Apr. 2010 (CEST)
Thiocarbamate
Hallo Roland, ich bin sicher, Du verfolgst diese Diskussion. Könntest Du die von Dir erstllten Dateien bitte auf die von Benutzer:rjh genannten korrekten Namen (Thiocarbamat.svg --> Thionocarbamat.svg, Thioirgendwas.svg --> Thiocarbamat.svg) verschieben, ich übernehme dann gerne den Einbau in den/die Artikel (es sei denn, Du machst das gleich mit). Danke! --Mabschaaf 21:27, 20. Mär. 2010 (CET)
- Hallo Mabschaaf, danke für den Hinweis, ich kann ja vor Thios fast nicht mehr schlafen ;-). Aber glaube, das Thiocarbamat ist schon ok aber Thioirgendwas ist das Thionocarbamat. Gruß -- Roland1952DiskBew. 23:36, 20. Mär. 2010 (CET)
- Auch das sehe ich nun als erledigt an. Auch hier vielen Dank! --Mabschaaf 17:39, 28. Mär. 2010 (CEST)
- Archivierung dieses Abschnittes wurde gewünscht von: -- Roland1952DiskBew. 00:07, 1. Apr. 2010 (CEST)
Cuban
Hallo Roland1952, ich finde es einen guten Vorschlag, die Cuban-Synthese neu zu zeichnen. Vielleicht könnte man die Reaktionsfolge in drei Abschnitte unterteilen, in denen die Synthesen beschrieben werden können. Gruss, Linksfuss 17:57, 27. Mär. 2010 (CET)
Die Darstellung von Cuban in einer dreizehnstufigen Synthese wurde erstmals 1964 publiziert.[1][2] Die Originalsynthese geht von 2-Cyclopentenon (1) aus, das zunächst in einer Wohl-Ziegler-Reaktion mit N-Bromsuccinimid zu (2) monobromiert wird. Die Tribromverbindung (3) wird durch Weiterbromierung mit elementarem Brom erhalten, aus der die eigentliche Ausgangsverbindung der Cuban-Synthese 2-Bromcyclopentadienon (4) durch Dehydrohalogenierung gewonnen wird:
Diese Ausgangsverbindung (2-Bromcyclopentadienon) wird in einem ersten Schritt über eine Diels-Alder-Reaktion zu (2) dimerisiert. Beiden Carbonylgruppen in (2) werden mit Ethylenglykol geschützt (2a). Anschließend wird die endo-ständige Acetal-Gruppe selektiv unter Bildung der Verbindung (3) hydrolysiert. Es schließt sich eine intramolekulare photochemische [2+2]-Cycloaddition Bromketon (4) an:
Das so gewonnene Bromketon wird über eine Faworski-Umlagerung durch Ring-Kontraktion zur Carbonsäure (5) umgelagert. Die freie Carbonsäure (5) wird dann in einen Peroxycarbonsäureester (6) überführt und danach thermisch zu (7) decarboxyliert:
Zuletzt wird die verbliebene Acetal-Gruppe ebenfalls hydrolysiert, das Bromketon (8) in einer zweiten Faworski-Reaktion umgelagert und die dabei entstehende Carbonsäure (9) in den entsprechenden Peroxycarbonsäureester (10) überführt. Das Zielmolekül Cuban (11) erhält man dann nach einer thermischen Decarboxylierung von (10):
wobei ich mir nicht im Klaren bin, ob man die Pfeile und Reaktionspfeilbeschreibungen weglassen sollte. Gruß -- Roland1952DiskBew. 21:04, 28. Mär. 2010 (CEST)
- Das würde das ganze natürlich noch etwas übersichtlicher machen. Ich denke die Erläuterungen im Text reichen aus... Viele Grüße, --Sponk 21:28, 28. Mär. 2010 (CEST)
- Hallo Roland! Die Reaktionsgleichungen sehen gut aus und sind nicht mehr so gequetscht und überladen wie in der Ursprungsfassung. Hier noch ein paar Anmerkungen:
- Reaktion von 1 nach 2: Ich würde das rechte Bromketon an der Vertikalen spiegeln (persönlicher Geschmack). Außerdem wandert eines der Doppelbindungselektronenpaare zum Brom-Atom des als Dienophil fungierenden Reaktionspartners. Das ist anhand der jetzt dargestellten Elektronenverschiebungspfeile mMn nicht gut erkennbar. Die Idee diese Pfeile einzuzeichnen finde ich jedoch gut. In der Ursprungsfassung sind die Moleküle lediglich überlagert dargestellt, da ist Deine Lösung eindeutig besser.
- Verbindung 2a: In der Struktur ist ein Fehler. Die Schützung der linken Carbonyl-Gruppe mit Ethylenglykol führt zu einem Dioxolan, das direkt am bicyclischen Ringsystem angebunden ist (Spiro-Struktur). In Deinem Fall ist versehentlich ein weiteres C-Atom dazwischen gerutscht.
- Verbindung 4: In der Struktur ist leider ebenfalls ein Fehler. Es fehlt die Bindung zwischen dem linken, bromierten C-Atom und dem linken, vorderen „Eckatom“ der zukünftigen Cuban-Struktur.
- Der Rest R müsste erläutert oder alternativ durch tBu ersetzt werden. Ich tendiere zu letzterem.
- Und zum Schluss noch einmal eine persönliche Geschmackssache: Ich würde lediglich serifenlose Schriften verwenden (also H2O, HBr und CO2 ebenfalls in einer serifenlosen Schrift setzen).
- Ansonsten sind die dargestellten Reaktionsgleichungen wesentlich übersichtlicher. Durch die von Linksfuss angeregte Aufspaltung in mehrere Einzelschritte wird der beschriebene Mechanismus mMn auch besser verständlich. Danke und viele Grüße, --Sponk 21:28, 28. Mär. 2010 (CEST)
- Hoffe alles richtig verstanden und umgesetzt zu haben. Gruß -- Roland1952DiskBew. 13:57, 29. Mär. 2010 (CEST)
- Super! Ein kleiner Kommentar sei mir hoffentlich noch erlaubt: Die Umlagerungspfeile der Faworski-Reaktion würde ich weglassen. Der Mechanismus ist nicht konzertiert, sondern läuft über mehrere Zwischenstufen. So sieht es fast so aus, als würde Kohlenmonoxid abgespalten werden. Deine Abbildungen sollten dann meiner Meinung nach in den Artikel eingebunden werden. Viele Grüße, --Sponk 18:12, 29. Mär. 2010 (CEST)
- Erlaubt ist alles, so es konstruktiv ist. Habe die Schemata eingebaut. Die Datei:Cubane_synthesis_1.PNG zeichne ich auch noch neu. Gruß -- Roland1952DiskBew. 20:00, 29. Mär. 2010 (CEST)
- Sehr gut, danke schön. Viele Grüße, --Sponk 20:30, 29. Mär. 2010 (CEST)
- .....wobei ich etwas in Verdrückung bin: Steffen 962 hat sich gestern erst die Mühe gemacht und die *.png-Datei gezeichnet. Hier die neue Version:
- Sehr gut, danke schön. Viele Grüße, --Sponk 20:30, 29. Mär. 2010 (CEST)
- Erlaubt ist alles, so es konstruktiv ist. Habe die Schemata eingebaut. Die Datei:Cubane_synthesis_1.PNG zeichne ich auch noch neu. Gruß -- Roland1952DiskBew. 20:00, 29. Mär. 2010 (CEST)
- Super! Ein kleiner Kommentar sei mir hoffentlich noch erlaubt: Die Umlagerungspfeile der Faworski-Reaktion würde ich weglassen. Der Mechanismus ist nicht konzertiert, sondern läuft über mehrere Zwischenstufen. So sieht es fast so aus, als würde Kohlenmonoxid abgespalten werden. Deine Abbildungen sollten dann meiner Meinung nach in den Artikel eingebunden werden. Viele Grüße, --Sponk 18:12, 29. Mär. 2010 (CEST)
- Hoffe alles richtig verstanden und umgesetzt zu haben. Gruß -- Roland1952DiskBew. 13:57, 29. Mär. 2010 (CEST)
- Ansonsten sind die dargestellten Reaktionsgleichungen wesentlich übersichtlicher. Durch die von Linksfuss angeregte Aufspaltung in mehrere Einzelschritte wird der beschriebene Mechanismus mMn auch besser verständlich. Danke und viele Grüße, --Sponk 21:28, 28. Mär. 2010 (CEST)
Gruß -- Roland1952DiskBew. 21:20, 29. Mär. 2010 (CEST)
- Hallo Roland, noch eine späte (Sorry!) Anmerkung von mir: In Molekül 10 findet sich noch das R, welches mit tert-Bu ersetzt werden sollte. Schöne Arbeit!--Mabschaaf 09:35, 30. Mär. 2010 (CEST)
- Besser spät als nie oder wie heißt es? Danke dir für den Hinweis. Ist geändert. Gruß -- Roland1952DiskBew. 11:37, 30. Mär. 2010 (CEST)
- Danke, und im 5-stufigen Syntheseschema lese ich in den Reaktionsbedingungen h·v - das sollte aber wohl h·ν (Ny) heißen, oder? (Ok, sehe gerade, auch hier ist in der Darstellung kein Unterschied zu sehen.) Viele Grüße --Mabschaaf 12:16, 30. Mär. 2010 (CEST)
- Das Problem ist, das beispielsweise Inkscape das „Ny“ nicht anders darstellt. Gruß -- Roland1952DiskBew. 13:23, 30. Mär. 2010 (CEST)
- Danke, und im 5-stufigen Syntheseschema lese ich in den Reaktionsbedingungen h·v - das sollte aber wohl h·ν (Ny) heißen, oder? (Ok, sehe gerade, auch hier ist in der Darstellung kein Unterschied zu sehen.) Viele Grüße --Mabschaaf 12:16, 30. Mär. 2010 (CEST)
- Besser spät als nie oder wie heißt es? Danke dir für den Hinweis. Ist geändert. Gruß -- Roland1952DiskBew. 11:37, 30. Mär. 2010 (CEST)
Cuban zu Cyclooctatrien
- Archivierung dieses Abschnittes wurde gewünscht von: -- Roland1952DiskBew. 01:09, 16. Apr. 2010 (CEST)
- ↑ P.E. Eaton, T.W. Cole: Cubane in J. Am. Chem. Soc. 86 (1964) 3157–3158. doi:10.1021/ja01069a041
- ↑ P.E. Eaton, T.W. Cole: The Cubane System in J. Am. Chem. Soc. 86 (1964) 962–964. doi:10.1021/ja01059a072