Cadmiumcarbonat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
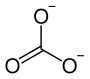
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cadmiumcarbonat | |||||||||||||||
| Andere Namen |
Kadmiumkarbonat | |||||||||||||||
| Summenformel | CdCO3 | |||||||||||||||
| Kurzbeschreibung |
weißer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 172,42 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,258 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt |
357 °C (Zersetzung)[1] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, erbgutverändernd (CMR), ernsthafte Auswirkungen auf die menschliche Gesundheit gelten als wahrscheinlich[5] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−750,6 kJ/mol[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Cadmiumcarbonat ist eine chemische Verbindung aus der Gruppe der Carbonate.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Cadmiumcarbonat kommt natürlich in Form des Minerals Otavit und als Zink-Cadmium-carbonat Cadmiumsmithsonit (Zn,Cd)CO3 vor.[7]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Cadmiumcarbonat kann durch Reaktion einer Cadmiumchlorid-Lösung mit Ammoniumcarbonat und anschließende Auflösung des entstehenden Niederschlags mit Ammoniak.[2]
Cadmiumcarbonat kann auch durch Reaktion einer Cadmiumchlorid-Lösung mit konzentrierter Salzsäure und Harnstoff gewonnen werden.[2]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Cadmiumcarbonat ist ein nicht brennbarer, weißer geruchloser Feststoff der sich bei Temperaturen größer als 357 °C zersetzt, wobei Cadmiumoxid und Kohlendioxid entstehen.[1] Es besitzt eine trigonale Kristallstruktur des Calcit-Typs mit der Raumgruppe R3c (Raumgruppen-Nr. 167) und den Gitterparametern a = 4,920 und c = 16,298 Å.[2]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Cadmiumcarbonat wird zur Herstellung von Cadmiumoxid und anderen Cadmiumsalzen (wie den Pigmenten Cadmiumgelb und Cadmiumrot) verwendet.[3]
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Auf Vorschlag der schwedischen Chemikalienbehörde wurde 2015 die chemikalienrechtliche Einstufung von Cadmiumcarbonat überarbeitet. Der Ausschuss für Risikobewertung (RAC) der Europäischen Chemikalienagentur (ECHA) hat am 4. Dezember die Einstufung für Cadmiumcarbonat wie folgt geändert: Cadmiumcarbonat wird als krebserzeugend Carc 1B, mutagen Muta 1B und STOT RE 1 eingestuft, die zusätzlichen Warnhinweise wurden festgelegt auf H340, H350 und H372 (Niere, Knochen).[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i Eintrag zu Cadmiumcarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3.
- ↑ a b Todini and Co.: Cadmiumcarbonat ( vom 12. Februar 2013 im Webarchiv archive.today)
- ↑ Eintrag zu cadmium carbonate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 15. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 19. Januar 2018.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- ↑ Mineralienatlas: Otavit, abgerufen am 4. Februar 2018.
- ↑ RAC-Entscheidung vom 4. Dezember 2015.
- Gesundheitsschädlicher Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Giftiger Stoff bei Einatmen
- Erbgutverändernder Stoff
- Krebserzeugender Stoff
- Stoff mit Verdacht auf reproduktionstoxische Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- CMR-Stoff
- SVHC-Stoff
- Carbonat
- Cadmiumverbindung
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 28
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 29
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 23
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 72



![{\displaystyle \mathrm {CdCl_{2}+(NH_{4})_{2}CO_{3}+NH_{3}\longrightarrow [Cd(NH_{3})_{4}]CO_{3}+NH_{4}Cl} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/0271e11559d89db999c4b55aa8e5c5026049115d)
![{\displaystyle \mathrm {[Cd(NH_{3})_{4}]CO_{3}\longrightarrow CdCO_{3}+4\ NH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d0cfe303a1bc5185c78905ca2db6f362058d0da)
