Magnesiumnitrid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
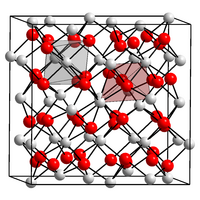
| ||||||||||||||||
| _ N3− _ Mg2+ | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Magnesiumnitrid | |||||||||||||||
| Verhältnisformel | Mg3N2 | |||||||||||||||
| Kurzbeschreibung |
beigefarbener Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 100,95 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,71 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
reagiert mit Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Magnesiumnitrid ist eine chemische Verbindung aus den Elementen Magnesium und Stickstoff. Es besitzt die Formel Mg3N2 und gehört zur Stoffgruppe der Nitride.
Geschichte[Bearbeiten | Quelltext bearbeiten]
Magnesiumnitrid wurde im Jahr 1862 erstmals von den deutschen Chemikern Friedrich Briegleb und Johann Georg Anton Geuther hergestellt und beschrieben.[3][4]
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Es entsteht als gelber Feststoff zum Beispiel beim Erhitzen von metallischem Magnesium auf ca. 300 °C unter Stickstoffatmosphäre.[5]
Diese Reaktion verläuft mit −462,8 kJ·mol−1 aus der festen Phase bzw. mit −479,6 kJ·mol−1 aus der flüssigen Phase stark exotherm.[6]
Ebenfalls möglich ist die Herstellung durch Reaktion von Magnesium und Ammoniak.[5]
Bei der Verbrennung von Magnesiummetall an Luft entsteht es neben Magnesiumoxid (MgO) und lässt dieses gelblich erscheinen.
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Magnesiumnitrid ist ein grünlichgelbes bis gelborange gefärbtes, lockeres Pulver. Es kristallisiert im kubischen Anti-Bixbyit Strukturtyp (a = 9,95 Å) und ist damit ein Typ-C Sesquioxid.[7][8] Mit Wasser hydrolysiert Magnesiumnitrid zu Magnesiumhydroxid und Ammoniak.[5]
Im historischen Serpek-Verfahren wurde diese Reaktion (neben der Hydrolyse von Aluminiumnitrid) zur Ammoniaksynthese eingesetzt (siehe Haber-Bosch-Verfahren).
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt Magnesiumnitrid bei Alfa Aesar, abgerufen am 15. Dezember 2010 (Seite nicht mehr abrufbar).
- ↑ a b Eintrag zu Magnesiumnitrid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ F. Briegleb, J. G. A. Geuther: Ueber das Stickstoffmagnesium und die Affinitäten des Stickgases zu Metallen in [[Ann. Chem. Pharm.]] 123 (1862) 228.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 93 pdf.
- ↑ a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 911.
- ↑ Yuan Chunmiao, Yu Lifu, Li Chang, Li Gang, Zhong Shengjun: Thermal analysis of magnesium reactions with nitrogen/oxygen gas mixtures in J. Hazard. Mat. 260 (2013) 707–714, doi:10.1016/j.jhazmat.2013.06.047.
- ↑ D. E. Partin, D. J. Williams, M. O'Keeffe: The Crystal Structures of Mg3N2and Zn3N2. In: Journal of Solid State Chemistry. Band 132, Nr. 1, 1. August 1997, S. 56–59, doi:10.1006/jssc.1997.7407.
- ↑ Linus Pauling, M. D. Shappell: 8. The Crystal Structure of Bixbyite and the C-Modification of the Sesquioxides. In: Zeitschrift für Kristallographie - Crystalline Materials. Band 75, Nr. 1, 1. Dezember 1930, S. 128–142, doi:10.1515/zkri-1930-0109.




