Mangan(III)-oxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
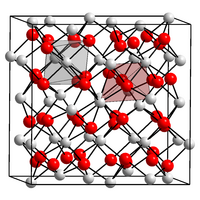
| ||||||||||||||||
| _ Mn3+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Mangan(III)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | Mn2O3 | |||||||||||||||
| Kurzbeschreibung |
schwarzer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 157,88 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
4,50 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,5 mg·m−3[1] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Mangan(III)-oxid ist ein Oxid des Mangans. In der Natur ist Mangan(III)-oxid als seltenes Mineral Bixbyit-(Mn) bekannt.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Es entsteht zum Beispiel in Zink-Braunstein-Zellen bei deren Entladung:
Mangan(III)-oxid entsteht auch bei der Zersetzung von Mangan(IV)-oxid (MnO2 bei Temperaturen über 535 °C).
Bei der Umsetzung einer Lösung von Mangansulfat-Tetrahydrat mit Wasserstoffperoxid und Ammoniak bei Raumtemperatur erhält man γ-MnO(OH) (Manganit). Aus diesem kann durch vorsichtige Entwässerung im Vakuum bei 250 °C γ-Mangan(III)-oxid erhalten werden.[2]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Mangan(III)-oxid ist ein nicht brennbarer schwarzer geruchloser Feststoff, der praktisch unlöslich in Wasser ist. Er zersetzt sich bei Erhitzung über 940 °C.[1] Das in der Natur nicht vorkommende γ-Mn2O3 besitzt eine tetragonale Kristallstruktur mit der Raumgruppe I41/amd (Nr. 141) (a = 577 pm, c = 944 pm).[2][3] Es wandelt sich bei 500 °C in 48 Stunden, bei Raumtemperatur in einem Jahr in die α-Form um. Diese hat bei Temperaturen über 29 °C eine kubische Bixbyit-Struktur mit der Raumgruppe Ia3 (Nr. 206) und darunter eine orthorhombische Struktur mit der Raumgruppe Pcab (Nr. 61, Stellung 2).[4][5] Bei höheren Drücken existieren auch noch andere Modifikationen. So besitzt das bei Drücken über 28 GPa synthetisierbare δ-Mn2O3 eine Kristallstruktur vom CaIrO3-Typ mit der Raumgruppe Cmcm (Nr. 63), ε-Mn2O3 eine Kristallstruktur vom Korund-Typ mit der Raumgruppe R3 (Nr. 148) und ζ-Mn2O3 eine verzerrte trikline Doppelperovskit-Struktur mit der Raumgruppe F1 (Nr. 2, Stellung 5)[6].[7]
Verwendung[Bearbeiten | Quelltext bearbeiten]
Mangan(III)-oxid wird als Ausgangsstoff zur Herstellung von Lithiummangan(III,IV)-oxid LiMn2O4 (Kathodenmaterial von Lithium-Ionen-Akkus) und als Pigment in Farbstoffen (färbt Glas z. B. braun) verwendet. Das Mischoxid mit Yttrium und Indium ergibt ein brillantes blaues Pigment, das YInMn-Blau. Die allgemeine Formel lautet YIn1-xMnxO3[8] Ist kein Mangan enthalten, ist das Oxid farblos, ist kein Indium enthalten, ist es schwarz.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g h i j Eintrag zu Mangan(III)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. März 2023. (JavaScript erforderlich)
- ↑ a b Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1582.
- ↑ Ferrimagnetism in γ-Manganese Sesquioxide (γ − Mn2O3) Nanoparticles, Journal of the Korean Physical Society, Vol. 46, No. 4, April 2005, S. 941–944.
- ↑ S. Geller: Structure of α-Mn2O3, (Mn0.983Fe0.017)2O3 and (Mn0.37Fe0.63)2O3 and relation to magnetic ordering. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 27, S. 821–828, doi:10.1107/S0567740871002966.
- ↑ Structure and magnetic properties of Mn2O3 ( des vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 713 kB), 2009.09.30 Lab seminar, Kaist, Jo Euna
- ↑ Die Nummerierung dieser Achsenstellung entspricht nicht der Reihenfolge der International Tables for Crystallography, da diese dort nicht aufgeführt wird.
- ↑ Source: A path to new manganites with perovskite structure, Sergey V. Ovsyannikov, Artem M. Abakumov, Alexander A. Tsirlin, Walter Schnelle, Ricardo Egoavil, J. o. Verbeeck, Gustaaf Van Tendeloo, Konstantin V. Glazyrin, Michael Hanfland, Leonid Dubrovinsky: Perovskite-like Mn2O3: A Path to New Manganites . In: Angewandte Chemie International Edition. 52, 2013, S. 1494–1498, doi:10.1002/anie.201208553.
- ↑ Andrew E. Smith, Hiroshi Mizoguchi, Kris Delaney, Nicola A. Spaldin, Arthur W. Sleight, M. A. Subramanian: Mn in Trigonal Bipyramidal Coordination: A New Blue Chromophore. In: Journal of the American Chemical Society. 131, 2009, S. 17084–17086, doi:10.1021/ja9080666.


