Mangan(II)-oxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
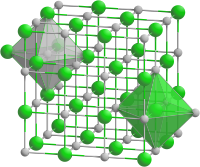
| ||||||||||||||||
| _ Mn2+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Mangan(II)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | MnO | |||||||||||||||
| Kurzbeschreibung |
grünes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 70,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,45 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
0,5 mg·m−3[1] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Mangan(II)-oxid ist eines der Oxide des Mangans mit der Formel MnO.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Manganoxid kommt in der Natur im Mineral Manganosit[3][4] vor.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Mangan(II)-oxid wird durch Reduktion von Mangan(IV)-oxid-haltigen Erzen mit Erdgas oder Kohle bei Temperaturen zwischen 400 und 1000 °C hergestellt. Gebildetes Mangan(II)-oxid muss unter Schutzgas abgekühlt werden, um eine Rückoxidation zum vierwertigen Mangan zu vermeiden.
Mangan(II)-oxid kann auch durch Erhitzung von Mangan(II)-carbonat MnCO3 im Vakuum gewonnen werden:[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Mangan(II)-oxid kristallisiert in der kubischen Natriumchlorid-Struktur. MnO ist bei tiefen Temperaturen ein antiferromagnetischer Isolator, dessen magnetische Struktur als einer der ersten Verbindungen aufgeklärt wurde.[6] Dafür wurden bereits 1951 Neutronenbeugungsexperimente durchgeführt,[7] die zeigten, dass die magnetischen Momente von Mn2+ sich jeweils entgegen denen aller ihrer Nachbarn ausrichten. Das ist die Bedeutung von Antiferromagnetismus: die magnetischen Momente sind gegeneinander ausgerichtet und heben sich damit auf, das Material erscheint erst einmal nicht-magnetisch. Diese Ausrichtung bedeutet aber auch, dass alle magnetischen Momente entlang der Raumdiagonale parallel zueinander ausgerichtet sind. Das führt bei sehr tiefen Temperaturen zu einer geringen rhomboedrischen Verzerrung genau entlang dieser Richtung, die mit [111] bezeichnet wird. Oberhalb der als Néel-Temperatur bezeichneten Ordnungstemperatur von 110 K wird Mangan(II)-oxid paramagnetisch.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Mangan(II)-oxid wird als Bestandteil von Gießpulver[8] in der metallverarbeitenden Industrie, als Düngemittelzusatz[9] bzw. Futtermittelzusatzstoff sowie als grünes Farbpigment beim Zeugdruck verwendet.
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Pulverförmiges, frisch hergestelltes Mangan(II)-oxid kann sich an der Luft selbst entzünden.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu CAS-Nr. 1344-43-0 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Mai 2017. (JavaScript erforderlich)
- ↑ National Pollutant Inventory: Manganese & compounds. abgerufen am 17. Februar 2015.
- ↑ Manganosit (Mineralienatlas)
- ↑ Die Entdeckung von Manganosit im Harz (Stollentroll)
- ↑ W. H. McCarroll: Oxides- solid state chemistry. In: R. Bruce King (Hrsg.): Encyclopedia of Inorganic chemistry. John Wiley & Sons, 1994, ISBN 0-471-93620-0.
- ↑ J. E. Greedon: Magnetic oxides. In: R. Bruce King (Hrsg.): Encyclopedia of Inorganic chemistry. John Wiley & Sons, 1994, ISBN 0-471-93620-0.
- ↑ C. G. Shull, W. A. Strauser, E. O. Wollan: Neutron Diffraction by Paramagnetic and Antiferromagnetic Substances. In: Phys. Rev. Band 83, 1951, S. 333–345. doi:10.1103/PhysRev.83.333
- ↑ G. Gigacher, Ch. Bernhard, W. Kriegner: Eigenschaften hochmanganhaltiger Stähle unter stranggießähnlichen Bedingungen. ( vom 29. September 2007 im Internet Archive)
- ↑ Mangan und seine Verbindungen (Uni Regensburg)


