Metriken der grünen Chemie
Metriken der grünen Chemie (auch: Kennwerte der grünen Chemie) beschreiben Aspekte eines chemischen Prozesses, die mit den 12 Prinzipien der grünen Chemie[1] zusammenhängen. Diese Metriken dienen dazu, die Effizienz oder die Nachhaltigkeit chemischer Prozesse zu quantifizieren. Durch sie sollen Effektivität oder Nachhaltigkeit chemischer Prozesse sowie die Veränderungen messbar gemacht werden. Motivation für den Einsatz von Metriken ist die Erwartung, dass die Quantifizierung technischer und ökologischer Verbesserungen den Nutzen neuer Technologien greifbarer, wahrnehmbarer oder verständlicher machen kann. Weiterhin dienen solche Metriken auch als Vergleichsmaßstab zu anderen ggf. weniger optimalen Prozessen.
Für Ausbeuteverbesserungen und erhöhte Selektivitäten können einfache Prozentsätze als Metriken ideal sein, aber dieser vereinfachte Ansatz ist möglicherweise nicht immer anwendbar. Wenn beispielsweise ein hochentzündliches Reagenz durch ein sichereres ersetzt wird, ist es schwierig, einen numerischen Wert für die Verbesserung zu bestimmen. Es ist jedoch offensichtlich, dass Verbesserungen vorliegen, wenn alle anderen Faktoren gleich bleiben.[2]
Im Laufe der Zeit wurden zahlreiche Metriken formuliert.[3][4] Die folgende Übersicht enthält eine alphabetische Auflistung einiger Metriken, erhebt jedoch keinen Anspruch auf Vollständigkeit. Ein generelles Problem besteht darin, dass je genauer und universeller die entwickelten Metriken sind, desto komplexer werden sie. Für professionelle Anwendungen gibt es computergestützte Systeme zur Analyse und Berechnung von Metriken. Es gibt einige Tabellenkalkulationsvorlagen und Softwarelösungen, die in der Lage sind, Metriken usw. zu berechnen.[3] Eine gute Kennzahl muss klar definiert, einfach, messbar und objektiv sein, um das gewünschte Verhalten zu fördern.
Typenübersicht zu den Metriken[Bearbeiten | Quelltext bearbeiten]
Der grundlegende Zweck von Metriken ist es, Vergleiche zu ermöglichen. Wenn es mehrere wirtschaftlich tragfähige Möglichkeiten gibt, ein Produkt herzustellen, welche verursacht die geringste Umweltbelastung – d. h. welche ist die umweltfreundlichste? Die zu diesem Zweck entwickelten Metriken lassen sich in zwei großen Typen einteilen: massenbasierte Metriken und wirkungsbasierte Metriken.
Die einfachsten Metriken basieren auf der Masse der Materialien und nicht auf deren Auswirkung. Atomökonomie, E-Faktor, Ausbeute, Reaktionsmasseneffizienz und effektive Masseneffizienz sind Kennzahlen, die die Masse des gewünschten Produkts mit der Masse des Abfalls vergleichen. Sie unterscheiden nicht zwischen schädlicheren und weniger schädlichen Abfällen. Ein Verfahren, bei dem weniger Abfälle anfallen, mag nach Maßstäben umweltfreundlicher erscheinen als die Alternativen, kann aber auch weniger umweltfreundlich sein, wenn der erzeugte Abfall besonders umweltschädlich ist. Diese gravierende Einschränkung bedeutet, dass massenbasierte Metriken nicht verwendet werden können, um zu bestimmen, welche synthetische Methode umweltfreundlicher ist.[5] Massenbasierte Metriken haben jedoch den großen Vorteil der Einfachheit: Sie können aus leicht verfügbaren Daten mit wenigen Annahmen berechnet werden. Für Unternehmen, die Tausende von Produkten herstellen, sind massenbasierte Messgrößen möglicherweise die einzige praktikable Option, um die unternehmensweite Verringerung von Umweltschäden zu überwachen. Unter den massenbasierten Metriken gibt es zwei verschiedene Gruppen, die Metriken, die einheitenlos bzw. sind und die Metriken, deren Einheit Prozent ist. Nachfolgend sind gängige massenbasierte Metriken inkl. deren Formel zur Berechnung und der jeweilige Optimalwert für die Metrik dargestellt.[3][4][6]
| massenbasierte Metrik | Abkürzung | oder % | Formel zur Berechnung | Optimalwert |
|---|---|---|---|---|
| E-Faktor | EF | 0 | ||
| Massenintensität | MI | 1 | ||
| Prozessmassenintensität | PMI | 1 | ||
| Reaktionsmassenintensität | RMI | 1 | ||
| Lösungsmittelintensität | SI | 0 | ||
| Abwasserintensität | WWI | 0 | ||
| Wasserintensität | WI | 0 | ||
| erneuerbare-Ressourcen Intensität | RI | 1 | ||
| E-Faktor (einfach) | sEF | 0 | ||
| E-Faktor (vollständig) | cEF | 0 | ||
| Abfallintensität | AI | 0 | ||
| Atomökonomie | AE | % | 100 % | |
| Kohlenstoffeffizienz | CE | % | 100 % | |
| Reaktionsmasseneffizienz | RME | % | 100 % | |
| Massenproduktivität | MP | % | 100 % | |
| effektive Massenausbeute | EMY | % | / | |
| erneuerbare-Ressourcen Prozentsatz | RP | % | 100 % | |
| optimale Effizienz | OR | % | 100 % |
Zur Ansicht der Tabelle rechts auf [Ausklappen] drücken.
Im Gegensatz dazu bewerten wirkungsbasierte Metriken, wie bei die Metrik EcoScale, sowohl die Umweltbelastung als auch die Masse, wodurch sie sich viel besser für die Auswahl der umweltfreundlichsten von mehreren Optionen oder synthetischen Wegen eignen. Einige von ihnen, z. B. für Versauerung, Ozonabbau und Ressourcenabbau, sind genauso einfach zu berechnen wie massenbasierte Metriken, erfordern aber Emissionsdaten, die möglicherweise nicht ohne weiteres verfügbar sind. Andere, wie die Toxizität für Inhalation, Ingestion und verschiedene Formen der aquatischen Ökotoxizität, sind komplexer zu berechnen, zusätzlich zu den erforderlichen Emissionsdaten.[7]
Atom- & Kohlenstoffeffizienz[Bearbeiten | Quelltext bearbeiten]
Atomökonomie[Bearbeiten | Quelltext bearbeiten]
Die Atomökonomie (auch Atomeffizienz, eng.: atom economy, AE) wurde 1991 von Barry M. Trost definiert.[8] Sie ist definiert als die gesamte Molmasse des gewünschten Produkts geteilt durch die Summe der gesamten Molmassen aller Edukte, ausgedrückt in Prozent.[9]
Der Prozentsatz der Atomökonomie bezieht sich auf den Anteil der Reaktanten, die in das Endprodukt eingehen.[8] Bei einer idealen Reaktion würden alle Atome der Reaktanten im gewünschten Produkt enden, dies entspricht einer Atomökonomie von . Die Atomökonomie ist ein rein theoretischer Wert und kann folglich schon bei der Planung eines chemischen Prozesses ermittelt werden.
Kohlenstoffeffizienz[Bearbeiten | Quelltext bearbeiten]
Eine Version der Atomökonomie ist die Kohlenstoffeffizienz (auch Kohlenstoffökonomie, eng.: carbon efficiency, CE), welche von Curzons et al. in 2001[10] erfunden wurde. Sie ist definiert als der prozentuale Anteil des Kohlenstoffs der Reaktanten, der im Endprodukt verbleibt.[11] Dementsprechend ist ihre Berechnung für eine generische Reaktion ähnlich der der Atomökonomie:
Ist aber die Reaktion :
Sie beschreibt, wie viele Kohlenstoffatome der Reaktanten im Produkt enden. Bei einer idealen Reaktion würde alle Kohlenstoffatome der Reaktanten im gewünschten Produkt enden, dies entspricht einer Kohlenstoffeffizienz von . Die Kohlenstoffeffizienz ist ein rein theoretischer Wert (ähnlich wie die Atomökonomie) und kann folglich schon bei der Planung eines chemischen Prozesses ermittelt werden.
Der Nachteil einer solchen Metriken ist, dass Annahmen getroffen werden müssen. In einem idealen chemischen Prozess entspricht die Menge der Ausgangsstoffe oder Reaktanten der Menge aller erzeugten Produkte und es geht kein Atom verloren. Bei den meisten Prozessen bleiben jedoch einige der Reaktanten-Atome als nicht reagierte Reaktanten zurück oder gehen bei einigen Nebenreaktionen in nicht betrachtete Nebenprodukte verloren, anstatt Bestandteil der Produkte zu werden. Außerdem werden Lösungsmittel und Energie, die für die Reaktion verwendet werden, in dieser Berechnung nicht berücksichtigt, aber sie können erhebliche Auswirkungen auf die Umwelt haben.
Ausbeute[Bearbeiten | Quelltext bearbeiten]
Die Ausbeute ist per se keine allein grüne Metrik, hier aber dennoch erwähnenswert. In der Chemie versteht man unter der Ausbeute einer Reaktion die Menge an gewonnenem Produkt. Die Ausbeute wird üblicherweise als Quotient der Stoffmengen an real gewonnenem Produkt und der theoretisch maximal möglichen Produktmenge ausgedrückt. So berechnet stellt sie eine stöchiometrische Verhältnisgröße dar und wird in der Regel in Prozent ausgedrückt.
Die theoretische Maximalmenge an Produkt entspricht der Stoffmenge des knappsten Edukts bzw. einem stöchiometrischen Bruchteil oder Vielfachen davon.
Da die Ausbeute durch das chemische Gleichgewicht beeinflusst werden kann, kann die Ausbeute durch das im großen Überschuss Hinzufügen eines oder mehrere Reaktanten erhöht werden. Diese Methode kann jedoch nicht als „grünere“ Methode angesehen werden, da dass bedeutet, dass eine größere Menge des überschüssigen Reaktanten nicht reagiert und somit verschwendet werden.
E-Faktoren & Umweltquotient[Bearbeiten | Quelltext bearbeiten]
E-Faktor[Bearbeiten | Quelltext bearbeiten]
Ende der 80er Jahre entwickelte Roger A. Sheldon den E-Faktor (auch Umweltfaktor, eng.: environmental factor, EF).[12][13] Der E-Faktor ist definiert als das Massenverhältnis des Abfalls zum gewünschten Produkt.[12][9][6] Er kann dementsprechend folgendermaßen berechnet werden:
- oder auch mit .
Das Inputmaterial bezieht sich auf die Reaktanten sowie auch auf die Lösungsmittel. Die Gesamtmassen werden normalerweise in Kilogramm (kg) oder Tonnen (t) angegeben. Ein höherer E-Faktor bedeutet mehr Abfall und folglich größere negative Umweltauswirkungen. Der ideale E-Faktor ist Null, d. h. nur das gewünschte Produkt entsteht und kein Abfall. Der E-Faktor ist relativ einfach und leicht verständlich und hebt die im Prozess entstehende Abfallmenge hervor, die bei einer bestimmten Produktmasse anfällt. Er hilft dabei eines der zwölf Prinzipien der grünen Chemie zu erfüllen, nämlich die Vermeidung von Abfall. Es ist besser, Abfälle zu vermeiden, als Abfälle zu behandeln oder zu beseitigen, nachdem sie entstanden sind. Diese Messgröße kann von der Industrie genutzt werden und Innovationen anregen, die zu einer Verringerung des Abfallaufkommens führen, wenn sie richtig eingesetzt wird.
Wiederverwendbare (recycelbare) Faktoren wie recycelte Lösungsmittel und wiederverwendbare Katalysatoren werden bei der Berechnung des E-Faktors ignoriert. Dies erhöht zwar dessen Genauigkeit, aber die bei der Rückgewinnung benötigte Energie wird nicht berücksichtigt (häufig werden diese theoretisch berücksichtigt, indem eine Rückgewinnung von 90 % des Lösungsmittels angenommen wird). In der Definition des E-Faktors schließt Sheldon Wasser generell von der Berechnung aus und er argumentierte, dass die Einbeziehung von Wasser zu außergewöhnlich hohen E-Faktoren führen und aussagekräftige Vergleiche von Prozessen erschweren kann.[14] Die Hauptschwierigkeit bei der Berechnung des E-Faktors besteht darin, Prozessgrenzen zu definieren, z. B. welche Phasen des Produktions- oder Produktlebenszyklus berücksichtigt werden müssen, bevor Berechnungen angestellt werden können.
Einfacher & vollständiger E-Faktor[Bearbeiten | Quelltext bearbeiten]
Der Umweltfaktor (E-Faktor) wurde an die Bedürfnisse der pharmazeutischen Industrie angepasst und es wurden basierend darauf zwei Metriken entwickelt. Ursprünglich wurde Abfall als „alles außer dem gewünschten Produkt“ oder als „die Nebenprodukte, die entstehen“ definiert. Wasser wurde jedoch mit der Begründung ausgeschlossen, dass die Einbeziehung von Wasser zu einer Verzerrung der E-Faktoren führen würde. Andererseits würde die Entsorgung oder Wiederverwendung des Wassers in vielen Fällen eine Art Vorbehandlung erfordern, was für die Einstufung als Abfall spricht.[4][6] Der einfache E-Faktor (eng.: simple E factor, sEF) berücksichtigt weder Lösemittel noch Wasser und ist eher für die frühe Routenplanung geeignet.[6]
Eine wichtige Abfallquelle bei der Herstellung von Chemikalien, insbesondere in der pharmazeutischen Industrie, ist der Verlust von Lösungsmitteln. Der vollständige E-Faktor (eng.: complete E factor, cEF) berücksichtigt alle Prozessmaterialien einschließlich Rohstoffen, Reagenzien, Lösungsmitteln und Wasser. Dabei wird kein Recycling angenommen. Dieser vollständige E-Faktor ist eher für die Analyse des gesamten Abfallstroms geeignet.[6]
Der tatsächliche kommerzielle E-Faktor wird irgendwo zwischen sEF und cEF liegen und kann berechnet werden, wenn zuverlässige Daten über Lösemittelverluste vorliegen.[4][6] Eine Schwäche des ursprünglichen E-Faktors bestand darin, dass Wasser in den Prozessen nicht berücksichtigt wurde, und wurde durch den vollständigen E-Faktor beseitigt.
Umweltquotient[Bearbeiten | Quelltext bearbeiten]
R. A. Sheldon führte 1994 den Umweltquotienten (eng.: environment quotient, EQ) ein,[15] weil der E-Faktor nur die Masse des erzeugten Abfalls berücksichtigt. Wichtig sind jedoch auch die Umweltauswirkungen dieses Abfalls und nicht nur ihre Menge, d. h. die Art des Abfalls muss berücksichtigt werden. Ein Kilogramm Natriumchlorid entspricht offensichtlich nicht einem Kilogramm Chromsalz.[16] Daher führte er den Begriff Umweltquotient ein der durch Multiplikation des E-Faktors mit einem willkürlich zugewiesenen Unfreundlichkeitsquotienten, Q, erhalten wird.[4][16]
So könnte man z. B. Natriumchlorid je nach Toxizität, Recyclingfreundlichkeit usw. willkürlich einen Q-Wert von 1 und einem Schwermetallsalz wie Chrom 100–1000 zuordnen.[16][4] Die Größenordnung von Q ist natürlich umstritten und schwer zu quantifizieren, aber vor allem ist eine „quantitative Bewertung“ der Umweltauswirkungen chemischer Prozesse grundsätzlich möglich.[16] Es ist auch darauf hinzuweisen, dass Q für einen bestimmten Stoff sowohl volumenabhängig als auch vom Standort der Produktionsanlagen beeinflusst sein kann.[16]
EcoScale[Bearbeiten | Quelltext bearbeiten]
Die EcoScale Metrik wurde 2006 in einem Artikel im Beilstein Journal of Organic Chemistry zur Bewertung der Effektivität einer synthetischen Reaktion vorgeschlagen.[17] Es zeichnet sich durch Einfachheit und allgemeine Anwendbarkeit aus. Wie die ertragsbasierte Skala gibt die EcoScale eine Punktzahl von 0 bis 100 an, berücksichtigt aber auch Kosten, Sicherheit, technischer Aufbau, Energie- und Reinigungsaspekte. Sie erhält man, indem man einer idealen Reaktion einen Wert von 100 zuweist, die folgendermaßen definiert ist: „Die Verbindung A (Substrat) wird mit (oder in Gegenwart von) preiswerten Verbindungen B so reagiert, dass die gewünschte Verbindung C bei Raumtemperatur zu 100 % bei minimalem Risiko für den Bediener und minimaler Auswirkung auf die Umwelt erzielt wird“, und dann Strafpunkte für nicht ideale Bedingungen subtrahiert. Diese Strafpunkte berücksichtigen sowohl die Vor- als auch die Nachteile bestimmter Reagenzien, Konfigurationen und Technologien.
Effektive Massenausbeute[Bearbeiten | Quelltext bearbeiten]
Hudlicky et al. schlugen eine Metrik vor, die als effektive Massenausbeute (eng.: effective mass yield, EMY) bezeichnet wird.[18] Sie ist als der prozentuale Anteil der Masse des gewünschten Produkts an der Masse aller bei seiner Synthese verwendeten nicht-gutartigen Materialien definieren.[18][11] Oder in einer Formel ausgedrückt[18]:
Diese Metrik versucht, die Ausbeute als den Anteil der Masse des Produkts zu definieren, der aus nichttoxischen (gutartigen) Materialien besteht. Wenn die meisten Reagenzien gutartig sind, kann die effektive Massenausbeute größer als 100 % sein. Diese Metrik erfordert die Definition eines gutartigen Stoffes. Während Hudlicky's Metrik den Versuch unternimmt, gutartig zu definieren (d. h. „die Nebenprodukte, Reagenzien oder Lösungsmittel, die keine bekannten Umweltrisiken mit sich bringen, z. B. Wasser, niedrigkonzentrierte Kochsalzlösung, verdünntes Ethanol, autoklavierte Zellmasse usw.“), mangelt es der Erklärung an einer eineindeutigen Definition.[11] Weiterhin kann die Metrik kritisiert werden, da nichts absolut harmlos bzw. gutartig ist (es ist ein subjektiver Begriff), und selbst die in der Definition aufgeführten Stoffe haben gewisse Umweltauswirkungen. In der Praxis ist es schwierig, „nicht-gutartig“ zu definieren, wenn man mit komplexen Reagenzien und Reagenzien arbeitet, für die nur begrenzte Informationen zur Umwelt- oder Arbeitsplatztoxizität vorliegen. Die Formel berücksichtigt auch nicht den Grad der Toxizität, der mit einem Verfahren verbunden ist. Bis alle toxikologischen Daten für alle Chemikalien vorliegen und ein Begriff für diese Mengen an „gutartigen“ Reagenzien in die Formel geschrieben wird, ist die effektive Masseneffizienz nicht die beste Metrik für die Chemie.
Die effektive Massenausbeute kann als angenähert werden, wobei E der E-Faktor ist (mit einer zusätzlichen Überlegung: Nebenprodukte, Reagenzien oder Lösungsmittel, von denen keine bekannten Umweltrisiken ausgehen (z. B. Wasser, niedrigkonzentrierte Kochsalzlösung, verdünntes Ethanol, autoklavierte Zellmasse usw.) werden nicht in die Berechnungen einbezogen).[18]
Erneuerbare-Ressourcen Intensität & Prozentsatz[Bearbeiten | Quelltext bearbeiten]
Erneuerbare-Ressourcen Intensität[Bearbeiten | Quelltext bearbeiten]
Die Metrik der erneuerbare-Ressourcen Intensität (eng.: renewables intensity, RI) wurde, um den prozentualen Anteil erneuerbarer Ausgangsprodukte an dem Produkt zu ermitteln, entwickelt.[14] Diese ist definiert als erneuerbaren Materialien (Ausgangsprodukte) im Zusammenhang zu der Gesamtmasse des erzeugten Produkts:
Jedoch ist bei der Bestimmung des Umfangs, in dem nachwachsende Rohstoffe über den gesamten Lebenszyklus – und nicht nur im Herstellungsprozess – eingesetzt werden, komplexer.
Erneuerbare-Ressourcen Prozentsatz[Bearbeiten | Quelltext bearbeiten]
Der Vergleich von der erneuerbare-Ressourcen Intensität mit der Prozessmasseintensität (PMI) ermöglicht dann die Berechnung eines erneuerbare-Ressourcen Prozentsatzes (eng.: renewables percantage, RP) unter der Voraussetzung, dass die gleichen Voraussetzungen für beide Werte (RI, PMI) gelten.[19]
Zusätzlich kann der RI auf die gleiche Weise wie PMI zerlegt und anschließend der RP für Reagenzien, Lösungsmittel usw. berechnet werden.[19]
Lösungsmittel-, Wasser-, Abwasser & Abfallintensität[Bearbeiten | Quelltext bearbeiten]
Lösungsmittelintensität[Bearbeiten | Quelltext bearbeiten]
Die Metrik der Lösungsmittelintensität (eng.: solvent intensity, SI) wurde eingeführt, da in der Herstellung von Arzneimitteln und Feinchemikalien Lösungsmittel verwendet werden und diese große Umweltauswirkungen haben können.[20][21] Sie wird unterschiedlich definiert. Einerseits beschreibt die Lösungsmittelintensität nach Lapkin und Constable das Verhältnis der Gesamtmasse an verwendeten Lösungsmitteln (ohne Wasser) zur Gesamtmasse die im Prozess verwendet wurde.[2]
Andererseits wird sie von Jiménez-González et al. als das Verhältnis zwischen der Gesamtmasse aller verwendeten Lösungsmittel (ohne Wasser) im Prozess zur Gesamtmasse des Produkts beschrieben.[14]
Wasserintensität[Bearbeiten | Quelltext bearbeiten]
Da die Lösungsmittelintensität Wasser aus den Berechnungen ausschließt[20], kann die Wasserintensität (eng.: water intensity, WI) eines Prozesses separat berechnet werden. Sie wird unterschiedlich definiert. Jiménez-González et al. definiert sie als die Gesamtmasse allen im Prozess verwendeten Wassers geteilt durch die Gesamtmasse des Produkts (ähnlich zur Lösungsmittelintensität).[14]
Fadel und Tarabieh definieren die Wasserintensität als das Verhältnis der Gesamtmasse an verwendetem Wasser zur Gesamtmasse die im Prozess verwendet wurde.[20][22]
Abwasserintensität[Bearbeiten | Quelltext bearbeiten]
Roger A. Sheldon erwähnte 2018 die Metrik der Abwasserintensität (eng.: waste water intensity, WWI).[4] Sie ist sehr ähnlich, wenn nicht auch gleich zur Wasserintensität. Die wird wie folgt berechnet:[4]
Abfallintensität[Bearbeiten | Quelltext bearbeiten]
Der Kennwert der Abfallintensität (eng.: waste intensity, AI) wird ähnlich zur Lösungsmittelintensität von Lapkin und Constable und der Wasserintensität von Fadel und Tarabieh berechnet.[2][20]
Massenintensität & -produktivität[Bearbeiten | Quelltext bearbeiten]
Massenintensität[Bearbeiten | Quelltext bearbeiten]
Curzons et al. haben 2001 die Metrik der Massenintensität (eng.: mass intensity, MI) erfunden.[10] Diese ist definiert als die Gesamtmasse (ohne die Masse des Wassers), die zur Herstellung einer Einheit eines Produkts erforderlich ist,[10] d. h. das Massenverhältnis der Gesamtmasse, die für die Reaktion (den Prozess) verwendet wird, zum gewünschten Produkt.
Die im Prozess verwendete Gesamtmasse umfasst alle Massen der Materialien, die in einem Prozess oder Prozessschritt verwendet werden, mit Ausnahme von Wasser; d. h. Reagenzien, Lösungsmittel, Katalysatoren usw. Die im Prozess verwendete Gesamtmasse umfasst auch alle Massen, die in Säure-, Laugen-, Salzlösungen und organischen Lösungsmitteln verwendet werden, sowie organische Lösungsmittel, die für Extraktionen, Kristallisationen oder Lösungsmittelwechsel verwendet werden.
Die Massenintensität (MI) kann ähnlich wie der E-Faktor interpretiert werden: Je höher die Massenintensität, desto ungünstiger ist der Prozess, da er viel Inputmasse pro Menge Endprodukt benötigt. Zudem wurde ein Vergleich zwischen der Massenintensität und dem E-Faktor hergestellt.[11] Dieser drückt sich in der folgenden Gleichung aus:
GlaxoSmithKline berichtete, dass Lösungsmittel typischerweise 80–90 % der Massenintensität eines im Chargenbetrieb hergestellten pharmazeutischen Verfahrens ausmachen.[14] Die Lösungsmittel machen jedoch nicht 90 % des Preises der Arzneimittel aus, so dass sich traditionell hauptsächlich auf die Erhöhung der Reaktionsausbeute konzentriert wurde, um aus den als teure Ausgangsstoffe angesehenen Rohstoffen den Maximalwert herauszuholen.[14]
Massenproduktivität[Bearbeiten | Quelltext bearbeiten]
Constable et al. haben 2002 die Metrik der Massenproduktivität (eng.: mass productivity, MP) erfunden.[11] Sie ist definiert als der Kehrwert der Massenintensität als Prozent ausgedrückt.[11] Nach dieser Definition ist die Massenproduktivität die ähnlich zu der effektiven Massenausbeute und der Atomökonomie.
Diese Kennzahl gibt Aufschluss darüber, wie viel von der Inputmasse, ausgedrückt in Prozent, in ein verkaufsfähiges Endprodukt einfließt.[2] Dies ist vielleicht wegen seines Schockwerts und seiner Deutungsfreundlichkeit, vor allem für nicht-technische Geschäftsleute, von Vorteil.
Prozessmassenintensität[Bearbeiten | Quelltext bearbeiten]
Die Metrik der Prozessmassenintensität (eng.: process mass intensity, PMI) wurde von Jimenez-Gonzalez et al. im Jahr 2011 entwickelt.[23] Die Prozessmasseintensität ist definiert als die Gesamtmasse der Materialien, die zur Herstellung einer bestimmten Produktmasse verwendet werden (ähnlich zur Definition der Massenintensität bloß, dass hier die Masse des Wassers auch betrachtet wird).[23]
Zu den Materialien, die zu den im Prozess verwendete Gesamtmasse (inkl. Wasser) gezählt werden, gehören Reagenzien, Reaktanten, Lösungsmittel, die für die Reaktion und Reinigung verwendet werden, und Katalysatoren. Die ideale Prozessmassenintensität ist 1, sprich kein Abfall entsteht und alle Materialien die für den Prozess benutzt werden finden sich im gewünschten Produkt wieder.
Bei den Berechnungen des E-Faktors und der Massenintensität wird das Wasser nicht mit einbezogen. Dies lag daran, dass Wasser es in der Regel nicht integraler Bestandteil der chemischen Reaktion war und die Auffassung vieler Personen in der Arzneimittelherstellung war, dass Wasser billig sei und keine Umweltbelastung darstelle.[14] Für die pharmazeutische Industrie ist diese Sichtweise jedoch nicht sinnvoll, da sie hoch reines Wasser (VE-Wasser) verwenden und es Auswirkungen auf den Lebenszyklus der Chemikalien und Geräte gibt, die zur Reinigung des Wassers verwendet werden.[14] Ein weiteres Problem in der Arzneimittelherstellung sind die dabei entstehenden Abfallgemische bestehend aus wässrigen und organischen Phasen, die möglicherweise zusätzlich vor der Abwasseraufbereitung voneinander getrennt werden müssen.[14] U. a. ist aus diesen Gründen die Prozessmassenintensität wichtig für die pharmazeutische Industrie. Diese hat im Rahmen des Green Chemistry Institute Pharmaceutical Roundtable der American Chemical Society die Prozessmassenintensität (PMI, die Gesamtmasse der Materialien pro Masse des Produkts) als wichtigste grüne Metrik ausgewählt.[23] Der Roundtable nutzt PMI routinemäßig zum Benchmarking der Umweltfreundlichkeit von Prozessen und nutzt es, um Effizienz und Innovation in der Arzneimittel und Feinchemieindustrie voranzutreiben.[23]
Reaktionsmasseneffizienz[Bearbeiten | Quelltext bearbeiten]
Die Reaktionsmasseneffizienz (eng.: reaction mass efficiency, RME) wurde wie die Kohlenstoffeffizienz von Curzons et al. entworfen.[10] Bei der Berechnung der Reaktionsmasseneffizienz werden die Atomökonomie (AE), die Ausbeute und die Stöchiometrie der Reaktanten einbezogen. RME ist der prozentuale Massenanteil der im isolierten Produkt verbleibenden Reagenzien,[11][10] sprich um diese Metrik für eine Reaktion berechnen zu können muss die Reaktion erst durchgeführt werden. Es gibt zwei Möglichkeiten, RME zu berechnen.[11][22]
Dies ist der allgemeine Ausdruck für die Berechnung der RME. Dabei ist die Ausbeute in Bezug auf das limitierende Reagenz (0 < < 1); AE steht für die Atomökonomie (0 < < 1); SF ist der stöchiometrische Faktor, der die Verwendung von überschüssigen Reagenzien berücksichtigt (SF = 1 für stöchiometrische Reaktionen, die ohne überschüssige Reagenzien durchgeführt werden, SF > 1 sonst); MRP ist der Parameter für die Materialrückgewinnung, er berücksichtigt andere Materialien, die in der Reaktions- und Nachreaktionsphase (Aufarbeitung und Reinigung) verwendet werden, wie z. B. Lösungsmittel und Waschmittel für Extraktionen sowie Lösungsmittel für die Chromatographie (0 < MRP < 1).[22] Oder vereinfacht kann sie folgendermaßen berechnet werden:[10]
Für eine generische Reaktion A + B → C ergibt sich:
Die Reaktionsmasseneffizienz zeigt zusammen mit allen oben genannten Kennzahlen die „Grünheit“ einer Reaktion, aber nicht eines Prozesses. Diese Metrik berücksichtigt nicht den gesamten erzeugten Abfall (wie z. B. der E-Faktor). Diese Metrik kann die Reaktion in einem Prozess als „grün“ oder „weniger grün“ evaluieren, sie bezieht dabei aber keine Lösungsmittel-, Aufarbeitungs- und Energieprobleme mit ein, die den Prozess weniger attraktiv machen könnten.
Stöchiometrie & stöchiometrischer Faktor[Bearbeiten | Quelltext bearbeiten]
Wie die Ausbeute ist auch die Stöchiometrie als solches keine Metrik, die rein zu grünen Chemie zuzuordnen ist. Die Stöchiometrie ist ein grundlegendes mathematisches Hilfsmittel in der Chemie. Mit ihrer Hilfe werden aus der qualitativen Kenntnis der Reaktanten und Produkte einer Reaktion die tatsächlichen Mengenverhältnisse (Reaktionsgleichung) und Stoffmengen berechnet. Praktisch werden Reaktionen im Labor häufig „unstöchiometrisch“ durchgeführt: Mindestens ein Reaktant wird im Überschuss eingesetzt und wird folglich nicht vollständig umgesetzt. Bei Gleichgewichtsreaktionen kann auf diese Weise das Gleichgewicht auf die Seite der Produkte verschoben werden, was besonders von Bedeutung ist, wenn einer der Reaktanten wesentlich teurer als die anderen ist. Diesen Effekte die bei Gleichgewichtsreaktionen auftreten kann sich die Industrie bei der Produktion von Chemikalien auch zu Nutze machen.
Ein Überschuss eines oder beider Reaktanten zur Maximierung der Reaktionsausbeute/-selektivität wird bei der Berechnung der Atomökonomie nicht berücksichtigt.[11] Hingegen wurde die Reaktionsstöchiometrie berücksichtigt. Wenn sich also zwei Moleküle eines Stoffes mit einem einzigen Molekül eines anderen verbinden, um ein neues Molekül zu bilden (entweder ein Reaktions- oder Prozesszwischenprodukt), wurde das entsprechende Verhältnis verwendet.[11]
Dazu wurde der stöchiometrische Faktor (eng.: stoichiometric factor, SF) eingeführt, um damit Reaktionen zu beschreiben, die unter Bedingungen ablaufen, bei denen ein oder mehrere Reagenzien in einer chemischen Reaktion im Überschuss verwendet werden, d. h. unter nicht stöchiometrischen Bedingungen. Der stöchiometrische Faktor wird, bspw. für folgende allgemeine Reaktion , wie folgt definiert:[24]
Hierbei ist die Masse des Überschusses B und ist die stöchiometrische Masse der Reaktanten. Ein SF von 1 bedeutet, dass die Reaktion unter stöchiometrischen Bedingungen abläuft, andernfalls ist SF > 1.
Vergleich von einigen Metriken[Bearbeiten | Quelltext bearbeiten]
Beispiele zur Berechnung einiger Metriken[Bearbeiten | Quelltext bearbeiten]
Ein Beispiel für die Berechnung der Atomökonomie, der Kohlenstoffeffizienz, der Reaktionsmasseneffizienz, der Massenintensität und der Massenproduktivität:[11] Benzylalkohol (10,81 g; 0,10 mol; 108,14 g·mol−1) wird mit p-Toluolsulfonylchlorid (21,9 g; 0,115 mol; 190,65 g·mol−1) in Toluol (500 g) und Triethylamin (15 g) zum Tosylate (262,29 g·mol−1) umgesetzt, der in 90%iger Ausbeute (0,09 mol; 23,6 g) isoliert wird.
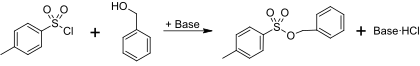
Es ergibt sich eine Atomökonomie von 87,8 %. Sie liegt wegen der Bildung von je ein Äquivalent Chlorwasserstoff als Nebenprodukt unter 100 %.
Die Kohlenstoffeffizienz berücksichtigt den Überschuss eines Reaktanten und die Ausbeute von weniger als 100 % des Produkts bezogen auf die Anzahl der Kohlenstoffe im Endmolekül.
Die Reaktionsmasseneffizienz berücksichtigt auch die 90%ige Ausbeute und die Notwendigkeit eines 15%igen molaren Überschusses an p-Toluolsulfonylchlorid.
Die Massenintensität berücksichtigt die Ausbeute, die Stöchiometrie, das Lösungsmittel und das in der Reaktionsmischung verwendete Reagenz.
Die Massenproduktivität beschreibt, dass rund 4,3 % von der Inputmasse in das Endprodukt einfließen.
Vergleich bei unterschiedlichen chemischen Reaktionen[Bearbeiten | Quelltext bearbeiten]
Um die Metriken Stöchiometrie, Ausbeute, Atomökonomie, Kohlenstoffeffizienz, Reaktionsmasseneffizienz, Massenintensität und Massenproduktivität verschiedene chemische Reaktionen zu veranschaulichen, sind der nachfolgenden Tabelle für vier chemische Reaktionen (Hydrierung, Sulfonierung, Decarboxylierung und Veresterung) dargestellt (der Artikel von Constable et al.[11] vergleicht 28 verschiedene chemische Reaktionen). Die Werte in der nachfolgenden Tabelle sind Mittelwerte von mindestens drei Beispielreaktionen für einen bestimmten Typ von chemischen Reaktionen.
| Stöchiometrie von B mol [%] | Ausbeute [%] | AE [%] | CE [%] | RME [%] | MI (exkl. Wasser) [kg/kg] | MP [%] | |
|---|---|---|---|---|---|---|---|
| Hydrierung | 192 | 89 | 84 | 74 | 74 | 18,6 | 5,4 |
| Sulfonierung | 142 | 89 | 89 | 85 | 69 | 16,3 | 6,1 |
| Decarboxylierung | 131 | 85 | 77 | 74 | 68 | 19,9 | 5,0 |
| Veresterung | 247 | 90 | 91 | 68 | 67 | 11,4 | 8,8 |
Grenzen der Metriken[Bearbeiten | Quelltext bearbeiten]
Metriken sind nur Abbildungen oder Repräsentationen der Merkmale eines Prozesses, die damit gemessen oder visualisiert werden sollen. Jede Metrik hat ihre Vorteile und kann spezifische Aspekte einer Synthese hervorheben und beschreiben. Die Metriken decken jeweils nicht alle Eigenschaften oder Aspekte eines Prozesses ab, sondern nur diejenigen, die für den jeweiligen Metrikersteller relevant erscheinen. Welche Aspekte für die jeweilige Metrik relevant sind, hängt stark vom Verwendungszweck der Metrik ab.
Der E-Faktor, ja alle massenbasierten Metriken, sind sehr stark vom Ausgangspunkt der Synthese abhängig, d. h. es ist notwendig, die Randbedingungen für die Berechnung der E-Faktoren zu definieren. In unserer ursprünglichen Entwicklung des Konzepts wurden E-Faktoren auf einer Gate-to-Gate-Basis berechnet, d. h. der Ausgangspunkt ist der Rohstoff, der in das Werkstor eintritt, und der Endpunkt ist das Produkt, das es verlässt. Der E-Faktor bezieht sich nur auf die Prozesse, die in der Fertigungsstätte durchgeführt werden. Allerdings kann ein Rohstoff, der in einer aktiver pharmazeutischer Wirkstoff Synthese verwendet wird, selbst ein fortgeschrittenes Zwischenprodukt sein, das in einem mehrstufigen Verfahren aus leicht verfügbaren Rohstoffen hergestellt wird. Tatsächlich können die E-Faktoren von heute auf morgen drastisch reduziert werden, wenn ein Zwischenprodukt gekauft wird, anstatt es vor Ort zu produzieren. Dies kann jedoch leicht zu Inkonsistenzen bei der Messung der Umweltfreundlichkeit von pharmazeutischen Prozessen führen. Daher müssen die mit beschafften Rohstoffen verbundenen intrinsischen E-Faktoren berücksichtigt werden. Eine Möglichkeit besteht darin, den Ausgangspunkt als handelsübliches, handelsübliches Rohmaterial zu definieren.[4]
Metriken der grünen Chemie im Chemieunterricht[Bearbeiten | Quelltext bearbeiten]
In der Chemielehre im Allgemeinen gibt es ein Dilemma bei der Erläuterung von Metriken der Grünen Chemie. Einerseits sollen den Lernenden Metriken vorgestellt werden, die für sie verständlich und relativ einfach zu berechnen sind. Dies sind zum Beispiel der E-Faktor und die Atomökonomie. An ihnen können die Lernenden sehen, wie damit versucht wird, Nachhaltigkeit zu quantifizieren. Diese einfachen Größen sind in der industriellen Praxis nur sehr begrenzt einsetzbar. Auf der anderen Seite werden die komplexeren Metriken, die in der Industrie verwendet werden, zu vieldimensional, um noch das große Ganze sichtbar zu machen. Für didaktische Fragestellungen wären diese komplexeren Metriken daher unbrauchbar, da sie deutlich schwerer zu berechnen und zu verstehen sind. Die Entscheidung, welche Metriken vermittelt werden sollen, muss daher von den Lehrenden in Abhängigkeit von der jeweiligen Lerngruppe getroffen werden.
Deutschland[Bearbeiten | Quelltext bearbeiten]
In Deutschland verabschiedete die Kultusministerkonferenz (KMK) 2019 einen Beschluss zu „inhaltliche Anforderungen für die Fachwissenschaften und Fachdidaktiken in der Lehrkräftebildung“[25][26], welcher wie der Name schon impliziert die Inhalte im Studium der Lehramtsstudierenden spezifiziert. In diesem wird, für die Lehrkräftebildung in der Chemie, das Thema „Nachhaltigkeit als Grundprinzip chemischer Forschung und Produktion“ vorgeschrieben, sodass werdende Lehrkräfte in Deutschland mit dem Thema der grünen Chemie im Studium (und damit verbunden auch mit ausgewählten Metriken der grünen Chemie) in Verbindung kommen.[26] Die Rahmenlehrpläne der Bundesländer spezifizieren das Lehren der Metriken der grünen Chemie hingegen nicht. Die 12 Kriterien von Green Chemistry werden jedoch in manchen Rahmenlehrplänen als möglichen Inhalt angeführt.
Niederlande[Bearbeiten | Quelltext bearbeiten]
Im niederländischen Chemieunterricht (ca. Sekundarstufe II) werden den Lernenden Inhalte der grünen Chemie beigebracht. Der E-Faktor und der Umweltquotient von Roger A. Sheldon, welcher in den Niederlanden als Professor tätig ist[27], werden im Unterricht gelehrt. Die beiden Metriken werden im niederländischen Unterricht als E-Faktor und Q-Faktor bezeichnet.[4] Zusehen ist dies u. a. in einem YouTube-Video eines niederländischen Lehrers.[28]
Literatur[Bearbeiten | Quelltext bearbeiten]
- Joel Martínez, J. Francisco Cortés, René Miranda: Green Chemistry Metrics, A Review. In: Processes. Band 10, Nr. 7, Juli 2022, S. 1274, doi:10.3390/pr10071274.
- Roger A. Sheldon: Metrics of Green Chemistry and Sustainability: Past, Present, and Future. In: ACS Sustainable Chemistry & Engineering. Band 6, Nr. 1, 2. Januar 2018, S. 32–48, doi:10.1021/acssuschemeng.7b03505.
- F. Roschangar, R. A. Sheldon, C. H. Senanayake: Overcoming barriers to green chemistry in the pharmaceutical industry – the Green Aspiration Level™ concept. In: Green Chemistry. Band 17, Nr. 2, 9. Februar 2015, S. 752–768, doi:10.1039/C4GC01563K.
Weblinks[Bearbeiten | Quelltext bearbeiten]
- Green Chemistry and Engineering Metrics. American Chemical Society (englisch).
- Stefan G. Koenig, Erin M. O’Brien: Useful Green Chemistry Metrics (englisch).
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ Paul Anastas, Nicolas Eghbali: Green Chemistry: Principles and Practice. In: Chemical Society Reviews. Band 39, Nr. 1, 14. Dezember 2009, ISSN 1460-4744, S. 301–312, doi:10.1039/B918763B (rsc.org [abgerufen am 15. Juli 2022]).
- ↑ a b c d Lapkin Alexei, Constable David: Green Chemistry Metrics. John Wiley & Sons, Ltd, Chichester, UK 2008, ISBN 978-1-4443-0543-2, doi:10.1002/9781444305432.
- ↑ a b c Joel Martínez, J. Francisco Cortés, René Miranda: Green Chemistry Metrics, A Review. In: Processes. Band 10, Nr. 7, Juli 2022, ISSN 2227-9717, S. 1274, doi:10.3390/pr10071274 (mdpi.com [abgerufen am 16. April 2024]).
- ↑ a b c d e f g h i j Roger A. Sheldon: Metrics of Green Chemistry and Sustainability: Past, Present, and Future. In: ACS Sustainable Chemistry & Engineering. Band 6, Nr. 1, 2. Januar 2018, ISSN 2168-0485, S. 32–48, doi:10.1021/acssuschemeng.7b03505.
- ↑ Sean M. Mercer, John Andraos, Philip G. Jessop: Choosing the Greenest Synthesis: A Multivariate Metric Green Chemistry Exercise. In: Journal of Chemical Education. Band 89, Nr. 2, 10. Januar 2012, ISSN 0021-9584, S. 215–220, doi:10.1021/ed200249v.
- ↑ a b c d e f F. Roschangar, R. A. Sheldon, C. H. Senanayake: Overcoming barriers to green chemistry in the pharmaceutical industry – the Green Aspiration Level™ concept. In: Green Chemistry. Band 17, Nr. 2, 9. Februar 2015, ISSN 1463-9270, S. 752–768, doi:10.1039/C4GC01563K (rsc.org [abgerufen am 17. April 2024]).
- ↑ Hans Bruijn, Robbert Duin, et al.: Handbook on Life Cycle Assessment: Operational Guide to the ISO Standards. Springer Dordrecht, 2002, ISBN 1-4020-0228-9, doi:10.1007/0-306-48055-7.
- ↑ a b Barry M. Trost: The Atom Economy—A Search for Synthetic Efficiency. In: Science. Band 254, Nr. 5037, 6. Dezember 1991, ISSN 0036-8075, S. 1471–1477, doi:10.1126/science.1962206.
- ↑ a b Roger A. Sheldon: Fundamentals of green chemistry: efficiency in reaction design. In: Chemical Society Reviews. Band 41, Nr. 4, 30. Januar 2012, ISSN 1460-4744, S. 1437–1451, doi:10.1039/C1CS15219J (rsc.org [abgerufen am 15. Juli 2022]).
- ↑ a b c d e f Alan D. Curzons, David J. C. Constable, David N. Mortimer, Virginia L. Cunningham: So you think your process is green, how do you know?—Using principles of sustainability to determine what is green–a corporate perspective. In: Green Chemistry. Band 3, Nr. 1, 1. Januar 2001, ISSN 1463-9270, S. 1–6, doi:10.1039/B007871I (rsc.org [abgerufen am 16. Juli 2022]).
- ↑ a b c d e f g h i j k l m David J. C. Constable, Alan D. Curzons, Virginia L. Cunningham: Metrics to ‘green’ chemistry—which are the best? In: Green Chemistry. Band 4, Nr. 6, 5. Dezember 2002, ISSN 1463-9270, S. 521–527, doi:10.1039/B206169B (rsc.org [abgerufen am 15. Juli 2022]).
- ↑ a b Roger A. Sheldon: The E Factor: fifteen years on. In: Green Chemistry. Band 9, Nr. 12, 22. November 2007, ISSN 1463-9270, S. 1273–1283, doi:10.1039/B713736M (rsc.org [abgerufen am 14. Juli 2022]).
- ↑ R. A. Sheldon: Organic synthesis; past, present and future. Chem. Ind., London 1992, S. 903–906.
- ↑ a b c d e f g h i Concepción Jiménez-González, David J. C. Constable, Celia S. Ponder: Evaluating the “Greenness” of chemical processes and products in the pharmaceutical industry—a green metrics primer. In: Chemical Society Reviews. Band 41, Nr. 4, 30. Januar 2012, ISSN 1460-4744, S. 1485–1498, doi:10.1039/C1CS15215G (rsc.org [abgerufen am 22. Juli 2022]).
- ↑ R. A. Sheldon: Consider the environmental quotient. In: CHEMTECH; (United States). Band 24:3, 1. März 1994, ISSN 0009-2703 (osti.gov [abgerufen am 16. Juli 2022]).
- ↑ a b c d e R. A. Sheldon: The E Factor. Abgerufen am 22. Juli 2022 (englisch).
- ↑ Koen Van Aken, Lucjan Strekowski, Luc Patiny: EcoScale, a semi-quantitative tool to select an organic preparation based on economical and ecological parameters. In: Beilstein Journal of Organic Chemistry. Band 2, Nr. 1, 3. März 2006, ISSN 1860-5397, S. 3, doi:10.1186/1860-5397-2-3, PMID 16542013 (beilstein-journals.org [abgerufen am 27. Juli 2022]).
- ↑ a b c d Tomas Hudlicky, Dean A. Frey, Lukasz Koroniak, Christopher D. Claeboe, Larry E. Brammer Jr: Toward a ‘reagent-free’ synthesis. In: Green Chemistry. Band 1, Nr. 2, 1. Januar 1999, ISSN 1463-9270, S. 57–59, doi:10.1039/A901397K (rsc.org [abgerufen am 16. Juli 2022]).
- ↑ a b C. Robert McElroy, Andri Constantinou, Leonie C. Jones, Louise Summerton, James H. Clark: Towards a holistic approach to metrics for the 21st century pharmaceutical industry. In: Green Chemistry. Band 17, Nr. 5, 12. Mai 2015, ISSN 1463-9270, S. 3111–3121, doi:10.1039/C5GC00340G (rsc.org [abgerufen am 22. Juli 2022]).
- ↑ a b c d Chris Fadel, Khaled Tarabieh: Development of an Industrial Environmental Index to Assess the Sustainability of Industrial Solvent-Based Processes. In: Resources. Band 8, Nr. 2, Juni 2019, ISSN 2079-9276, S. 115, doi:10.3390/resources8020115 (mdpi.com [abgerufen am 22. Juli 2022]).
- ↑ Kim Alfonsi, Juan Colberg, Peter J. Dunn, Thomas Fevig, Sandra Jennings: Green chemistry tools to influence a medicinal chemistry and research chemistry based organisation. In: Green Chemistry. Band 10, Nr. 1, 3. Januar 2008, ISSN 1463-9270, S. 31–36, doi:10.1039/B711717E (rsc.org [abgerufen am 22. Juli 2022]).
- ↑ a b c Alexei Lapkin, David J. C. Constable: Green chemistry metrics: measuring and monitoring sustainable processes. Wiley, Chichester 2009, ISBN 978-1-4051-5968-5.
- ↑ a b c d Concepcion Jimenez-Gonzalez, Celia S. Ponder, Quirinus B. Broxterman, Julie B. Manley: Using the Right Green Yardstick: Why Process Mass Intensity Is Used in the Pharmaceutical Industry To Drive More Sustainable Processes. In: Organic Process Research & Development. Band 15, Nr. 4, 15. Juli 2011, ISSN 1083-6160, S. 912–917, doi:10.1021/op200097d.
- ↑ John Andraos: Unification of Reaction Metrics for Green Chemistry: Applications to Reaction Analysis. In: Organic Process Research & Development. Band 9, Nr. 2, 1. März 2005, ISSN 1083-6160, S. 149–163, doi:10.1021/op049803n.
- ↑ Deutscher Bildungsserver: Ländergemeinsame inhaltliche Anforderungen für die Fachwissenschaften und Fachdidaktiken in der Lehrerbildung (Beschluss der Kultusministerkonferenz vom 16.10.2008 i.d.F. vom 14.03.2019). 25. Juni 2019, abgerufen am 22. Juli 2022.
- ↑ a b KMK: Ländergemeinsame inhaltliche Anforderungen für die Fachwissenschaften und Fachdidaktiken in der Lehrerbildung. (PDF) Abgerufen am 22. Juli 2022.
- ↑ R. A. Sheldon: Curriculum Vitae: Roger A. Sheldon. Abgerufen am 22. Juli 2022 (englisch).
- ↑ De E-factor en Q-factor - Scheikundelessen.nl. scheikundelessen, abgerufen am 22. Juli 2022 (niederländisch).














































