Nickel(II)-fluorid
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| __ Ni2+ __ F− | ||||||||||
| Allgemeines | ||||||||||
| Name | Nickel(II)-fluorid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | NiF2 | |||||||||
| Kurzbeschreibung |
gelber, kristalliner Feststoff (Reinstoff)[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 96,69 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
4,7 g·cm−3[1] | |||||||||
| Schmelzpunkt |
1450 °C[2] | |||||||||
| Löslichkeit |
in Wasser löslich[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Nickel(II)-fluorid ist eine chemische Verbindung der Elemente Nickel und Fluor. Der Reinstoff ist ein gelber, sehr hygroskopischer, kristalliner Feststoff, der bei 1000 °C schmilzt. Als weitere Formen existieren das Nickel(II)-fluorid-trihydrat, NiF2 · 3 H2O, und Nickel(II)-fluorid-tetrahydrat, NiF2 · 4 H2O.[2][5][6]
Gewinnung und Darstellung
Nickel(II)-fluorid kann aus den Elementen bei höheren Temperaturen synthetisiert werden:[5]
- Nickel und Fluor reagieren im Molverhältnis 1:1 bei 550 °C zu Nickel(II)-fluorid.
Auch möglich ist die Reaktion von Nickel mit Flusssäure:[5]
Eine weitere Möglichkeit ist die Reaktion von Nickel(II)-chlorid mit Fluor bei 350 °C, wobei die Chloridionen zu Chlor oxidiert werden:[2][5]
Eigenschaften
Physikalische Eigenschaften
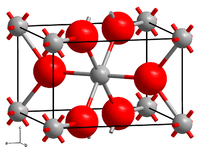
Nickel(II)-fluorid kristallisiert im tetragonalen Kristallsystem mit der Raumgruppe P42/mnm (Raumgruppen-Nr. 136) und den Gitterparametern a = 465,08 pm und c = 308,37 pm, in der Elementarzelle befinden sich zwei Formeleinheiten.[6]
Nickel(II)-fluorid-tetrahydrat kristallisiert im orthorhombischen Kristallsystem mit der Raumgruppe P21ab (Raumgruppen-Nr. 29, Stellung 3) und den Gitterparametern a = 798,5 pm, b = 1248,2 pm und c = 572 pm, in der Elementarzelle befinden sich vier Formeleinheiten.[6]
Chemische Eigenschaften
Bei Kontakt mit Mineralsäuren entsteht hochgiftiger Fluorwasserstoff,[3] hier als Beispielsäure Salpetersäure:
Die Dehydratation und Zersetzung von Nickel(II)-fluorid-tetrahydrat findet in mehreren Stufen statt. Bei 125 °C werden drei Moleküle Wasser abgegeben, es entsteht das Monohydrat NiF2 · H2O. Bei 225 °C wird Wasser und Fluorwasserstoff abgespalten und es entsteht ein Zwischenprodukt mit der stöchiometrischen Zusammensetzung NiOHF · 3NiF2. Nachdem bei 430 °C ein weiteres Molekül Fluorwasserstoff abgespalten wird, bleibt in wasserfreier Atmosphäre ein Gemisch aus Nickel(II)-oxid und Nickel(II)-fluorid zurück, andernfalls ist das Endprodukt reines Nickel(II)-oxid.[7]
Komplexe
Nickel(II)-fluorid bildet mit Fluoriden Tetrafluorkomplexe:[5]
Diese Tetrafluorkomplexe haben eine Schichtstruktur, in denen NiF6-Oktaeder miteinander verknüpft sind.[8]
Einzelnachweise
- ↑ a b Nickel(II)-fluorid auf webelements.com
- ↑ a b c Norman N. Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage, Wiley-VCH, Weinheim 1988, ISBN 3-527-26169-9.
- ↑ a b Datenblatt Nickel(II)-fluorid bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ Eintrag zu CAS-Nr. 10028-18-9 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ a b c d e A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1713.
- ↑ a b c Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 640 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ B. A. Lange, H. M. Haendler: "The thermal decomposition of nickel and zinc fluoride tetrahydrates" in Journal of Inorganic and Nuclear Chemistry 1973, 35 (9), S. 3129-3133. doi:10.1016/0022-1902(73)80010-7
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1756.






