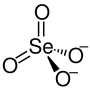
Nickel(II)-selenat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Nickel(II)-selenat | ||||||||||||
| Summenformel | NiSeO4 | ||||||||||||
| Kurzbeschreibung |
grüner Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 201,64 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte | |||||||||||||
| Löslichkeit |
löslich in Wasser (350 g·l−1 bei 20 °C)[3] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Nickel(II)-selenat ist eine anorganische chemische Verbindung des Nickels aus der Gruppe der Selenate.
Vorkommen[Bearbeiten | Quelltext bearbeiten]
Nickelselenat kommt natürlich in Form eines Mischkristalls mit Cobaltselenat als Mineral Ahlfeldit vor.
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
Nickelselenat kann durch Reaktion von Nickel(II)-carbonat mit Selensäure gewonnen werden.[5]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
Nickelselenat ist als Hexahydrat ein grüner Feststoff.[1] Er besitzt eine tetragonale Kristallstruktur mit der Raumgruppe P41212 (Raumgruppen-Nr. 92).[6] Das bei Erhitzung des Hexahydrates ab etwa 100 °C langsam entstehende Tetrahydrat hat eine Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2), die Dihydrat eine orthorhombische Kristallstruktur. Ab 510 °C zersetzt sich die Verbindung, wobei sich unter Sauerstoffabspaltung Nickelselenit sowie Nickel(II)-oxid und Selendioxid bildet.[7][2]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Eintrag zu Nickelselenat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Dezember 2019. (JavaScript erforderlich)
- ↑ a b R. J. Meyer: Nickel Teil B — Lieferung 2. Verbindungen bis Nickel-Polonium. Springer-Verlag, 2013, ISBN 978-3-662-13302-6 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 94th Edition. CRC Press, 2016, ISBN 978-1-4665-7115-0, S. 78 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Nickel selenate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 30. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Jane E. Macintyre: Dictionary of Inorganic Compounds, Supplement 4. CRC Press, 1996, ISBN 978-0-412-75020-5, S. 219 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. Fuess: Die Kristallstruktur von Nickelselenat-hexahydrat. In: Zeitschrift für anorganische und allgemeine Chemie. 379, 1970, S. 204, doi:10.1002/zaac.19703790212.
- ↑ D. Stoilova, V. Koleva: TG, DTA, DSC and X-ray powder diffraction studies on some nickel selenate hydrates. In: Thermochimica Acta. 290, 1997, S. 85, doi:10.1016/S0040-6031(96)03062-6.
- Krebserzeugender Stoff
- Erbgutverändernder Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Nickelverbindung
- Selenat
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 27
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 28
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 30



![{\displaystyle \mathrm {NiSeO_{4}\cdot 6H_{2}O\ {\xrightarrow[{-H_{2}O}]{300\,^{\circ }C}}\ NiSeO_{4}\cdot H_{2}O\ {\xrightarrow[{-H_{2}O}]{390\,^{\circ }C}}\ NiSeO_{4}\ {\xrightarrow[{-O_{2}}]{510\,^{\circ }C}}\ NiSeO_{3}\ {\xrightarrow[{-SeO_{2}}]{690\,^{\circ }C}}\ NiO} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae9bca30b2eaa6cc17535421ace34846e6081d83)