Nitriloxide
| Nitriloxide |
|---|
|
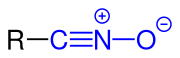
| Allgemeine Struktur der Nitriloxide mit der blau markierten Nitriloxid-Funktion. Der Rest R stellt dabei einen aliphatischen, cyclischen oder aromatischen Rest oder auch ein Wasserstoff-Atom (Knallsäure) dar. |
Nitriloxide sind eine Stoffgruppe der organischen Verbindungen mit der allgemeinen Struktur R–CNO, wobei R ein kohlenstoffhaltiger Rest ist. Formal leiten sie sich von der instabilen Knallsäure ab.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Nitriloxide können aus Hydroxyimidoylchloriden hergestellt werden, indem diese mit einer Base umgesetzt werden[1] oder unter Bestrahlung in Benzol mit Hexabutyldistannan.[2] Die direkte Herstellung von Nitriloxiden aus Aldoximen ist mit Natriumhypobromit möglich, das in situ aus Brom und Natriumhydroxid gebildet wird.[3] Die Oxidation von Aldoximen mit Iodosobenzol ergibt ebenfalls Nitriloxide.[4]
Eine andere Methode ist die Dehydratisierung von primären Nitroverbindungen. Geeignete Reagenzien sind hierfür para-Toluolsulfonsäure in Mesitylen, Natriumacetat in Acetanhydrid und Ethylchlorformiat beziehungsweise Benzolsulfonylchlorid mit Triethylamin. Das wichtigste Reagenz ist jedoch 4-Chlorphenylisocyanat. Daneben eignet sich auch das Burgess-Reagenz.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Nitriloxide sind sehr reaktiv. Daher werden sie meist in situ erzeugt und direkt weiter umgesetzt. Sie gehen insbesondere 1,3-dipolare Cycloadditionen an Alkene ein, wodurch Isoxazole oder Isoxazoline erhalten werden. Ihre Dimerisierung führt zu Furoxanen.[5][6]
Die Dimerisierung von aliphatischen Nitriloxiden ist sehr schnell, bei aromatischen Vertretern kann sie hingegen einige Stunden bis Tage dauern. Nitriloxide mit sterisch gehinderten Resten wie Mesitylen lassen sich rein darstellen.[3]
Stabile Nitriloxide gehen einige weitere Reaktionen ein. Durch Reaktion mit Trimethylphosphit können sie wieder zu Nitrilen reduziert werden. Durch Kochen in Xylol oder Decalin lagern sie sich zu Isocyanaten um.[3]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Manfred Christl, Rolf Huisgen: 1,3-Dipolare Cycloadditionen, 74. Orientierungsphänomene bei Cycloadditionen aliphatischer und aromatischer Nitriloxide an α,β-ungesättigte Carbonester. In: Chemische Berichte. Band 106, Nr. 10, 1973, S. 3345–3367 2, doi:10.1002/cber.19731061019 (PDF).
- Christoph Grundmann, Judith M. Dean: Nitrile Oxides. V. Stable Aromatic Nitrile Oxides 1,2. In: The Journal of Organic Chemistry. Band 30, Nr. 8, 1965, S. 2809–2812, doi:10.1021/jo01019a074.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Yi Lim, Michelle Ong, Russell Hewitt: Improved Synthesis of Glucosinolates. In: Synthesis. Band 50, Nr. 08, April 2018, S. 1640–1650, doi:10.1055/s-0036-1591895.
- ↑ Byeang Hyean Kim: Reaction of Hydroximic Chlorides with Hexabutylditin. A Mild Method for Generation and Cycloaddition of Nitrile Oxides. In: Synthetic Communications. Band 17, Nr. 10, Juli 1987, S. 1199–1206, doi:10.1080/00397918708063971.
- ↑ a b c Christoph Grundmann, Judith M. Dean: Nitrile Oxides. V. Stable Aromatic Nitrile Oxides 1,2. In: The Journal of Organic Chemistry. Band 30, Nr. 8, August 1965, S. 2809–2812, doi:10.1021/jo01019a074.
- ↑ Nirbhik Chatterjee, Palash Pandit, Samiran Halder, Amarendra Patra, Dilip K. Maiti: Generation of Nitrile Oxides under Nanometer Micelles Built in Neutral Aqueous Media: Synthesis of Novel Glycal-Based Chiral Synthons and Optically Pure 2,8-Dioxabicyclo[4.4.0]decene Core. In: The Journal of Organic Chemistry. Band 73, Nr. 19, 3. Oktober 2008, S. 7775–7778, doi:10.1021/jo801337k.
- ↑ a b Nathalie Maugein, Alain Wagner, Charles Mioskowski: New conditions for the generation of nitrile oxides from primary nitroalkanes. In: Tetrahedron Letters. Band 38, Nr. 9, März 1997, S. 1547–1550, doi:10.1016/S0040-4039(97)00101-9.
- ↑ Jae Nyoung Kim, Eung K. Ryu: A convenient synthesis of benzohydroximoyl chlorides as nitrile oxide precursors by hydrogen chloride/N,N-dimethylformamide/oxone system. In: The Journal of Organic Chemistry. Band 57, Nr. 24, November 1992, S. 6649–6650, doi:10.1021/jo00050a054.