Oxepan
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | Oxepan | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C6H12O | |||||||||
| Kurzbeschreibung |
klare, leicht gelbliche Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 100,16 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig | |||||||||
| Dichte |
0,90 g·cm−3[2] | |||||||||
| Siedepunkt | ||||||||||
| Brechungsindex |
1,4400 (20 °C)[4] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Oxepan ist eine chemische Verbindung aus der Gruppe der gesättigten Heterocyclen. Es handelt sich um den einfachsten siebengliedrigen sauerstoffhaltigen Heteroaliphaten.
Darstellung
Die Darstellung von Oxepan gelingt aus der Cyclisierung von 1,6-Hexandiol in DMSO bei 190 °C, jedoch nur in schlechter Ausbeute.[6] Eine weitere Möglichkeit, die jedoch eine vergleichbar schlechte Ausbeute liefert, ist die Cyclisierung von 1,6-Dichlorhexan mit Kaliumhydroxid.[7]
Reaktionen
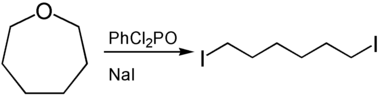
Oxepane können durch Ringöffnung zur Darstellung von α,ω-funktionalisierten Derivaten des Hexans genutzt werden. Zur Ringöffnung können Lewis- oder Brønsted-Säuren herangezogen werden. So liefert die Umsetzung von Oxepan mit Phenyldichlorphosphat und Natriumiodid 1,6-Diiodhexan.[8]
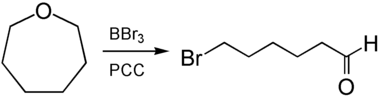
Aus der Reaktion mit Bortribromid mit anschließender Oxidation durch PCC ist 6-Bromhexanal zugänglich.[9]
Einzelnachweise
- ↑ a b Eintrag zu Hexamethylene Oxide bei TCI Europe
- ↑ A. Müller, W. Vanc, in: Monatsh. Chem., 1947, 77, S. 259–263.
- ↑ A. Misono, T. Osa, Y. Sanami, in: Bull. Chem. Soc. Jpn., 1968, 41, S. 2447–2453.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-408.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ V. J. Traynelis, W. L. Hergenrother, H. T. Hanson, J. A. Valicenti, in: J. Org. Chem., 1964, 29, S. 123–129.
- ↑ H. A. Zahalka, Y. Sasson, in: Synthesis, 1986, 9, S. 763–765.
- ↑ H.-J. Liu, L. M. Shewchuk, M. Llinas-Brunet, in: Heterocycles, 1986, 24, S. 3043–3046.
- ↑ S. U. Kulkarni, U. Surendra, V. D. Patil, in: Heterocycles, 1982, 18, S. 163–167.