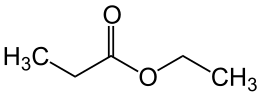
Propionsäureethylester
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Propionsäureethylester | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C5H10O2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 102,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[2] | |||||||||||||||
| Dichte |
0,89 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
99 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,384 (20 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Propionsäureethylester ist eine chemische Verbindung aus der Gruppe der Carbonsäureester.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Propionsäureethylester kommt natürlich in geringer Menge in Früchten wie Kiwi[6] und Erdbeeren[7] vor. Es kommt ebenfalls in Wein vor.[8]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Propionsäureethylester kann durch Veresterung von Ethanol mit Propionsäure oder Propionsäureanhydrid gewonnen werden.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Propionsäureethylester ist eine flüchtige, leicht entzündbare, farblose Flüssigkeit mit fruchtigem Geruch, die wenig löslich in Wasser ist. Sie zersetzt sich bei Erhitzung, wobei Kohlendioxid, Kohlenmonoxid und Ethen entstehen können.[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Propionsäureethylester wird als Lösungsmittel für Celluloseether und -Ester sowie für verschiedene natürliche und synthetische Harze verwendet. Es dient auch als Aromastoff (z. B. in Fruchtsirup).[3]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Die Dämpfe von Propionsäureethylester können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 12 °C, Zündtemperatur 455 °C) bilden.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu ETHYL PROPIONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 19. Januar 2022.
- ↑ a b c d e f g h i j k l Eintrag zu Ethylpropionat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b c d Eintrag zu Ethyl Propionate in der Hazardous Substances Data Bank (via PubChem), abgerufen am 22. Juli 2013.
- ↑ Datenblatt Ethyl propionate, ≥97% bei Sigma-Aldrich, abgerufen am 22. Juli 2013 (PDF).
- ↑ Eintrag zu Ethyl propionate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ John P. Bartley, Alan M. Schwede: Production of volatile compounds in ripening kiwi fruit (Actinidia chinensis). In: Journal of Agricultural and Food Chemistry. 37, 1989, S. 1023–1025, doi:10.1021/jf00088a046.
- ↑ Ana G. Perez, Jose J. Rios, Carlos. Sanz, Jose M. Olias: Aroma components and free amino acids in strawberry variety Chandler during ripening. In: Journal of Agricultural and Food Chemistry. 40, 1992, S. 2232–2235, doi:10.1021/jf00023a036.
- ↑ Hans-Dieter Belitz, Werner Grosch, Peter Schieberle: Lehrbuch der Lebensmittelchemie. Springer, 2001, ISBN 3-540-41096-1, S. 910 (eingeschränkte Vorschau in der Google-Buchsuche).
