Trihydroxybenzoesäuren
Zur Navigation springen
Zur Suche springen
Die Trihydroxybenzoesäuren bilden in der Chemie eine Stoffgruppe von aromatischen Verbindungen, die sich sowohl von der Benzoesäure als auch von den Trihydroxybenzolen ableitet. Die Struktur besteht aus einem Benzolring mit einer angefügten Carboxygruppe (–COOH) und drei Hydroxygruppen (–OH) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich sechs Konstitutionsisomere mit der Summenformel C7H6O5.
| Trihydroxybenzoesäuren | ||||||||
| Name | 2,3,4-Trihydroxybenzoesäure | 2,3,5-Trihydroxybenzoesäure | 2,3,6-Trihydroxybenzoesäure | 2,4,5-Trihydroxybenzoesäure | 2,4,6-Trihydroxybenzoesäure | 3,4,5-Trihydroxybenzoesäure | ||
| Andere Namen | 4-Pyrogallolcarbonsäure | Phloroglucincarbonsäure | Gallussäure | |||||
| Strukturformel | 
|

|

|
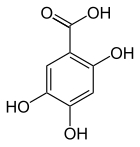
|

|
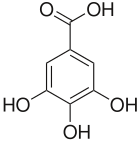
| ||
| CAS-Nummer | 610-02-6 | 33580-60-8 | 16534-78-4 | 610-90-2 | 83-30-7 | 149-91-7 | ||
| PubChem | 11874 | 134974 | 134719 | 69129 | 66520 | 370 | ||
| ECHA-InfoCard | 100.009.279 | 100.001.334 | 100.005.228 | |||||
| Summenformel | C7H6O5 | |||||||
| Molare Masse | 170,12 g·mol−1 | |||||||
| Aggregatzustand | fest | |||||||
| Schmelzpunkt | ~205 °C[1] | 205 °C[2] | 251 °C (Zersetzung)[3] | |||||
| pKs-Wert (25 °C) | 1,68[4] | 4,21[5] | ||||||
| GHS- Kennzeichnung |
|
|
kein Gefährlicher Stoff nach GHS[3] | |||||
| H- und P-Sätze | 315‐319‐335 | 315‐319‐335 | keine H-Sätze | |||||
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||||||
| 261‐305+351+338 | 261‐305+351+338 | keine P-Sätze | ||||||
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt 2,3,4-Trihydroxybenzoic acid bei Sigma-Aldrich, abgerufen am 9. Mai 2012 (PDF).
- ↑ a b Datenblatt 2,4,6-Trihydroxybenzoic acid bei Sigma-Aldrich, abgerufen am 9. Mai 2012 (PDF).
- ↑ a b Eintrag zu 3,4,5-Trihydroxybenzoesäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2023. (JavaScript erforderlich)
- ↑ D'Ans-Lax: Taschenbuch für Chemiker und Physiker, 3. Auflage, Band 1, Springer-Verlag, Berlin-Göttingen-Heidelberg 1967 (ChemieOnline – pKb- und pKs-Werte ( vom 12. Juli 2012 im Internet Archive)).
- ↑ L. Settimo, K. Bellman, R. M. Knegtel: Comparison of the accuracy of experimental and predicted pKa values of basic and acidic compounds. In: Pharmaceutical research. Band 31, Nummer 4, April 2014, S. 1082–1095, doi:10.1007/s11095-013-1232-z, PMID 24249037.
