Trimedlure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Struktur von 4- (oben) und 5-Chlor-2-methylcyclohexancarbonsäure-butylester (unten), jeweils ohne Darstellung der Stereochemie, siehe Zusammensetzung | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trimedlure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C12H21ClO2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 230,6 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
schwer löslich in Wasser (1 g·l−1 bei 20 °C)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Trimedlure ist die Bezeichnung für ein Gemisch mehrerer isomerer chemischer Verbindungen aus der Gruppe der Carbonsäureester. Trimedlure gehört zu den Insektenpheromonen und ist der wirksamste synthetische Sexuallockstoff der Mittelmeerfruchtfliege. Das (1S,2S,4R)-Isomer besitzt die höchste Wirksamkeit. Das Iod-Derivat ist unter dem Namen Ceralure bekannt.[1]
Darstellung und Gewinnung[Bearbeiten | Quelltext bearbeiten]
Die Herstellung von Trimedlure geht von der trans-6-Methyl-3-cyclohexencarbonsäure aus, an welche im ersten Schritt Chlorwasserstoff addiert wird. Dieser Schritt ist nicht stereospezifisch, so dass das 4-Chlor- und das 5-Chlor-Isomer der trans-2-Methylcyclocarbonsäure entstehen. Im zweiten Schritt erfolgt eine Veresterung durch die Umsetzung mit Isobuten.[3] Bei der Synthesesequenz entsteht ein Gemisch von vier der theoretisch möglichen acht razemischen Stereoisomeren, die mittels präparativer Chromatographie getrennt werden können.[7] Eine enantiomerenreine Darstellung der biologisch aktivsten (1S,2S,4R)- und (1S,2S,5R)-Isomeren ist durch die Verwendung der entsprechenden enantiomerenreinen Ausgangsverbindungen der trans-6-Methyl-3-cyclohexencarbonsäure möglich.[8]
Zusammensetzung und Eigenschaften[Bearbeiten | Quelltext bearbeiten]
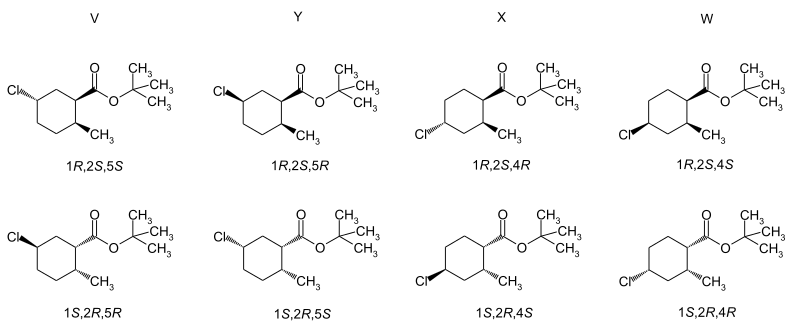
Trimedlure stellt ein Gemisch verschiedener Isomere dar. Wegen der aus der Synthese resultierenden unterschiedlichen Chlorsubstitution liegt ein Gemisch zweier Strukturisomere vor. Jedes der Moleküle enthält drei Stereozentren, so dass jeweils vier cis-trans-Isomere formuliert werden können, die jedes wiederum ein Enantiomerenpaar bildet. Insgesamt sind also 16 verschiedene Isomere möglich. Da die Synthese von der trans-6-Methyl-3-cyclohexencarbonsäure ausgeht,[3] sind im kommerziellen Produkt im Wesentlichen die resultierenden trans-Isomeren enthalten.[7] In der Literatur werden die vier Enantiomerenpaare als A, B1, B2 und C benannt. Die Zusammensetzung beträgt etwa 35 % A, 5 % B1, 10 % B2 und 50 % C.[7] Das biologisch aktivste Isomer ist das (1S,2S,4R)-Enantiomer des C-Enantiomerenpaars.[9] Beim strukturisomeren A-Enantiomerenpaar ist das (1S,2S,5R)-Enantiomer ebenfalls biologisch wesentlich aktiver.[9]
Die cis-Isomeren sind im kommerziellen Produkt mit etwa 5 % enthalten. Die Literatur nutzt die Bezeichnung der Enantiomerenpaare mit V, W, X und Y.[10][11] Eine chromatographische Auftrennung und Isolierung ist möglich.[10][11]
Über die Eigenschaften der Trimedlure-Isomeren gibt es nur wenige Informationen. Die Racemate des 4-Chlorderivats liegen als niedrigschmelzende, kristalline Feststoffe vor, während die des 5-Chlorderivate viskose Öle bilden.[7]
| Isomer | Typ | CAS-Nummer | Schmelzpunkt[7] | Brechungsindex[7] | Drehwert[8] |
|---|---|---|---|---|---|
| A | Racemat | 92284-32-7 | 1,4579 | ||
| A | (1R,2R,5S)-Enantiomer | 92344-63-3 | −4,7° | ||
| A | (1S,2S,5R)-Enantiomer | 92344-64-4 | +6,7° | ||
| B1 | Racemat | 92314-24-4 | 1,4576 | ||
| B1 | (1R,2R,5R)-Enantiomer | 92344-65-5 | +25,7° | ||
| B1 | (1S,2S,5S)-Enantiomer | ||||
| B2 | Racemat | 92284-33-8 | 71–72 °C | ||
| B2 | 1R,2R,4R-Enantiomer | 92344-66-6 | −19,2° | ||
| B2 | 1S,2S,4S-Enantiomer | 92344-67-7 | +27,9° | ||
| C | Racemat | 92284-34-9 | 57–58 °C | ||
| C | (1R,2R,4S)-Enantiomer | 92344-68-8 | −20,4° | ||
| C | (1S,2S,4R)-Enantiomer | 92344-69-9 | +19,6° |
Zulassung[Bearbeiten | Quelltext bearbeiten]
Die Verwendung des Wirkstoffs Trimedlure in Pflanzenschutzmitteln ist in der Europäischen Union und in der Schweiz nicht erlaubt.[12][13]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c Robert Krieger (Hrsg.): Hayes' Handbook of Pesticide Toxicology. Elsevier, 1999, ISBN 978-0-12-374367-1, S. 172 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Interchem Technologies
- ↑ a b c Beroza, M.; Green, N.; Gertler, S.I.: New Attractants for the Mediterranean Fruit Fly in J. Acricul. Food Chem. 9 (1961) 361–365, doi:10.1021/jf60117a007.
- ↑ Eintrag zu Trimedlure in der BioPesticide Properties DataBase (BPDB) der University of Hertfordshire, abgerufen am 30. November 2013.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 1,1-dimethylethyl 4(or 5)-chloro-2-methylcyclohexanecarboxylate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 28. November 2017.
- ↑ a b M. Beroza et al.: Acute toxicity studies with insect attractants. Toxicol Appl Pharmacol. 1975 (3):421-429. doi:10.1016/0041-008X(75)90264-1
- ↑ a b c d e f T. M. McGovern, M. Beroza: Structure of the Four Isomers of the Insect Attractant Trimedlure. In: J. Org. Chem. Band 31, 1966, S. 1472–1477, doi:10.1021/jo01343a036 (englisch).
- ↑ a b P. E. Sonnet, T. P. McGovern, R. T. Conningham: Enantiomers of the biologically active components of the insect attractant trimedlure. In: J. Org. Chem. Band 49, 1984, S. 4639–4643, doi:10.1021/jo00198a012 (englisch).
- ↑ a b Doolittle, R.E.; Cunningham, R.T.; McGovern, T.P.; Sonnet, P.E.: Trimedlure enantiomers: differences in attraction for mediterranean fruit fly, Ceratitis capitata (Wied.) (Diptera: Tephritidae) in J. Chem. Ecol. 17 (1991) 475–484, doi:10.1007/BF00994346.
- ↑ a b Warthen, J.D.; McGovern, T.P.: Purification of cis-trimedlure isomers by high-performance liquid chromatography in Chromatographia 21 (1986) 651–654, doi:10.1007/BF02311922.
- ↑ a b Warthen, J.D.; McGovern, T.P.: Semi-preparative high-performance liquid chromatographic separation of trimedlure isomers in Chromatographia 25 (1988) 811–814, doi:10.1007/BF02262090.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Trimedlure in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs und Deutschlands, abgerufen am 26. März 2016.
- ↑ Entscheidung der Kommission vom 30. Januar 2004 über die Nichtaufnahme bestimmter Wirkstoffe in Anhang I der Richtlinie 91/414/EWG des Rates sowie den Widerruf der Zulassungen für Pflanzenschutzmittel mit diesen Wirkstoffen (2004/129/EG)