Monoklonale Gammopathie unklarer Signifikanz
| Klassifikation nach ICD-10 | |
|---|---|
| D47.2 | Monoklonale Gammopathie |
| ICD-10 online (WHO-Version 2019) | |
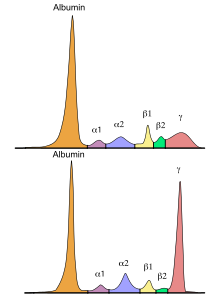

Die Monoklonale Gammopathie unklarer Signifikanz (MGUS) ist eine Paraproteinämie und die Vorstufe einer malignen lymphoproliferativen Erkrankung, z. B. eines Multiplen Myeloms, des Morbus Waldenström oder einer Amyloidose. Es werden monoklonale Immunglobuline und/oder Immunglobulinbestandteile (z. B. freie Leichtketten), welche auch als M-Protein/-Gradient oder Paraprotein bezeichnet werden, produziert.[1] Der Immunglobulin-Isotyp kann vom Typ IgG, IgA, IgM, IgD oder IgE sein, es können aber auch ausschließlich freie Leichtketten vom Typ kappa oder lambda vorliegen.[1][2]
Die MGUS stellt per Definition nur einen Vorläufer einer malignen hämatologischen Erkrankung dar, weil die Kriterien für eine solche Diagnose nicht erfüllt sind. Eine MGUS findet sich in einem vergleichsweise großen Anteil der Personen im Alter über 50 Jahren (1–3 %; entsprechend 4–5 Neuerkrankungen pro 100.000 Personen im Jahr).[3] Die Inzidenz steigt mit zunehmendem Alter an, wobei Männer etwas häufiger als Frauen betroffen sind. Die MGUS kann sich im Verlauf in ein Schwelendes Myelom (Smouldering Multiples Myelom) entwickeln, welches als weitere asymptomatische Vorstufe gilt.
Diagnostische Untersuchungen[Bearbeiten | Quelltext bearbeiten]
Um die Ausschlussdiagnose MGUS stellen zu können, müssen verschiedene Untersuchungen durchgeführt werden. Dazu gehören neben einer grundlegenden Anamnese verschiedene Laborparameter:[4][5][6]
Quantitative und qualitative Untersuchung des M-Proteins[Bearbeiten | Quelltext bearbeiten]
Bei bisher ungeklärtem M-Proteinmuster kann durch folgende Kombination eine eindeutige Bestimmung des Typs und der Konzentration des M-Proteins vorgenommen werden:
- Serumeiweißelektrophorese
- Immunfixationselektrophorese (Serum und Urin)
- Quantitative Bestimmung der freien Leichtketten Kappa und Lambda im Serum inkl. Berechnung des Quotienten (Ratio)
Weitere Laborparameter[Bearbeiten | Quelltext bearbeiten]
- Blutbild einschließlich Differentialblutbild
- Elektrolyte (Natrium, Kalium, Kalzium)
- Nierenretentionsparameter (Kreatinin inkl. berechneter GFR, Harnstoff)
- Gesamteiweiß und Albumin im Serum
- Quantitative Bestimmung der Immunglobuline (IgG, IgA, IgM)
- Qualitativer Test auf Eiweiß im Urin
Diagnosekriterien[Bearbeiten | Quelltext bearbeiten]
Nachweis einer monoklonalen Antikörperproduktion, sowie:[7]
- M-Protein <30g/l
- <10 % Plasmazellen im Knochenmark
- keine Organschäden (CRAB-Kriterien, aus dem Englischen für HyperCalcemia (Hyperkalzämie), Renal Insufficiency (Niereninsuffizienz), Anemia (Anämie) und Bone Lesions (Osteolysen))
Für eine IgM-MGUS gelten leicht modifizierte Kriterien:[7]
- M-Protein <30g/l
- <10 % lymphoplasmozytäre Infiltration im Knochenmark
- Keine Anzeichen für eine Anämie, konstitutionelle Symptome, ein Hyperviskositätssyndrom, eine Lymphadenopathie, eine Hepatosplenomegalie oder andere Organschäden, die auf die lymphoproliferative Erkrankung zurückzuführen sind.
Risikofaktoren[Bearbeiten | Quelltext bearbeiten]
Umweltfaktoren[Bearbeiten | Quelltext bearbeiten]
Verschiedene Umweltfaktoren werden als mögliche Risiken zur Entwicklung einer MGUS diskutiert:[5]
- Übergewicht
- Pestizide
- Strahlung
- Autoimmunerkrankungen
- Häufige Entzündungen und Infektionen
Genetische Faktoren[Bearbeiten | Quelltext bearbeiten]
In etwa 10 % konnte eine Mutation des MYD88-Gens in B-Zellen aus dem Knochenmark und dem peripheren Blut nachgewiesen werden, wie sie auch beim Morbus Waldenström besteht.[8] Translokationen der Immunglobulin Schwerkette (IgH) in den chromosomalen Bereichen 4p16, 6p21, 11q13, 16q23 sowie 20q11 und eine Hyperdiploidie gelten ebenfalls als frühe Veränderungen, welche zur Entwicklung einer MGUS beitragen.[5] Außerdem ist bei Personen mit Verwandten ersten Grades, bei denen eine MGUS nachgewiesen wurde, das Risiko der Entwicklung einer MGUS erhöht.[3]
Prognose[Bearbeiten | Quelltext bearbeiten]
| Faktoren | Risiko | nach 20 Jahren | nach 20 Jahren* |
|---|---|---|---|
| 0 | Niedrig | 5 % | 2 % |
| 1 | Niedrig – Mittel | 21 % | 10 % |
| 2 | Mittel – Hoch | 37 % | 18 % |
| 3 | Hoch | 58 % | 27 % |
| * unter Berücksichtigung der durchschnittlichen Lebenserwartung | |||
Eine MGUS geht mit einer durchschnittlichen Wahrscheinlichkeit von etwa 1 bis 1,5 % jährlich in ein weiteres Stadium über.[9][10] Der Übergang in eine symptomatische Erkrankung verläuft allerdings nicht zwangsläufig linear, sondern kann auch nach einer stabilen Phase plötzlich und rapide stattfinden. Man kann hier zwischen einem evolving- und non-evolving-MGUS unterscheiden.[11] Daher sind Verlaufskontrollen eines einmal diagnostizierten MGUS sinnvoll. Liegt mindestens ein Risikofaktor vor, wird eine Kontrolle nach 6 Monaten und danach jährlich empfohlen. Wenn die Laborkonstellation stabil scheint, kein Risikofaktor vorliegt und der Patient sonst keine Hinweise auf eine symptomatische Erkrankung zeigt, werden meist Kontrollen nach 6 Monaten und dann im Abstand von 2 bis 3 Jahren empfohlen.[12]
Anhand folgender Faktoren kann das Risiko einer Weiterentwicklung (Progression) der MGUS abgeschätzt werden:[12]
- abnormales Verhältnis der Freien Leichtketten
- M-Protein im Serum > 15 g/l
- M-Protein vom Typ IgA, IgM, IgD oder IgE
Für MGUS-Patienten, bei denen ausschließlich freie Leichtketten produziert werden (Leichtketten-MGUS; LC-MGUS), beträgt das Risiko für die Progression zu einer malignen Erkrankung ca. 0,3 % pro Jahr. Allerdings wird bei nahezu einem Viertel aller Betroffenen im weiteren Verlauf eine Beeinträchtigung der Nierenfunktion beobachtet.[2] Eine regelmäßige Kontrolle (6 Monate nach Diagnose und danach jährlich) ist auch hier anzuraten.[5] Entsprechend wird zwischenzeitlich nicht nur das per Definition symptomatische Multiple Myelom von den Vorläufer-Stadien abgegrenzt, sondern auch die sogenannte Monoklonale Gammopathie renaler Signifikanz (MGRS). Sie erfüllt zwar ebenfalls nicht die Kriterien des Multiplen Myeloms, stellt aber dennoch eine maligne Erkrankung dar.[13]
MGUS-assoziierte Erkrankungen[Bearbeiten | Quelltext bearbeiten]
MGUS-assoziierte Erkrankungen ohne direkten Bezug zum M-Protein[Bearbeiten | Quelltext bearbeiten]
Folgende Erkrankungen treten bei MGUS-Patienten gehäuft auf:[5] Infektionen (2-fach), Osteoporose, myeloische Erkrankungen (2-8-fach) und Thrombose (2-3-fach). Die Überlebensrate von Betroffenen ist kürzer als bei der Normalbevölkerung (8,1 gegenüber 11,8 Jahre; angepasst an Alter und Geschlecht). Ein durch Infektionen, Nierenerkrankungen, Herzerkrankungen etc. bedingtes höheres Sterberisiko kann Folge einer symptomatischen Manifestation der MGUS sein.
MGUS-assoziierte Erkrankungen mit Bezug zum M-Protein[Bearbeiten | Quelltext bearbeiten]
Monoklonale Proteine können durch Ablagerung in den Organen oder autoimmuner Aktivität schwere Organschäden herbeiführen. Folgende Erkrankungen können auftreten: Systemische Manifestationen (z. B. Herzerkrankungen), neurologische Erkrankungen (z. B. periphere Neuropathie), hämatologische Erkrankungen, Hauterkrankungen, metabolische Erkrankungen, Nierenerkrankungen (z. B. MGRS).[5]
Sekundäre MGUS[Bearbeiten | Quelltext bearbeiten]
Nach Therapie eines Multiplen Myeloms können Monoklonale Gammopathien mit verändertem Isotyp auftreten (sekundäre MGUS). Die Häufigkeit liegt nach einer autologen Stammzelltransplantation bei bis zu 73 % und bei Patienten ohne Transplantation bei bis zu 33 %. Eine sekundäre MGUS beruht nicht auf dem Wiederauftreten der Erkrankung, sondern auf der oligoklonalen Rekonstitution des sich aufbauenden Immunsystems und sollte nicht therapiert werden.[5]
Monoklonale Gammopathie renaler Signifikanz[Bearbeiten | Quelltext bearbeiten]
Aufgrund der potenziell nephrotoxischen Eigenschaften freier Leichtketten kann es im Verlauf der MGUS bereits zu einer symptomatischen Nierenerkrankung kommen, wobei man von einer Monoklonalen Gammopathie renaler Signifikanz (MGRS) spricht. Es ist daher sinnvoll sowohl bei der Diagnosestellung als auch während des Krankheitsverlaufs auf Komplikationen zu achten, die durch Ablagerungen von monoklonalen Proteinen im Gewebe bedingt sein können. Diese Erkrankungen sind zwar selten, können aber mit einer signifikanten Morbidität einhergehen und eine hämatologische Therapie unter nephrologischen Gesichtspunkten rechtfertigen.[5]
Behandlung[Bearbeiten | Quelltext bearbeiten]
Per Definition handelt es sich bei der MGUS nicht um eine maligne Erkrankung, die einer Behandlung bedürfte. Erst bei der Ausbildung von Symptomen in Form von Organschäden (z. B. CRAB-Kriterien) ist eine Behandlung aus hämatologischer Sicht indiziert.[7] Bei MGUS-assoziierten Erkrankungen ist eine palliative Therapie notwendig, die in bestimmten Fällen (wie der MGRS) auch eine hämatologisch-onkologische Therapie miteinschließen kann.[14]
Literatur[Bearbeiten | Quelltext bearbeiten]
- S. V. Rajkumar, A. Dispenzieri, R. A. Kyle: Monoclonal gammopathy of undetermined significance, Waldenström macroglobulinemia, AL amyloidosis, and related plasma cell disorders: diagnosis and treatment. In: Mayo Clin Proc., 2006 May, 81(5), S. 693–703. Review. PMID 16706268
- M. Kortüm et al.: DGHO-Leitlinien „Monoklonale Gammopathie unklarer Signifikanz“ (MGUS). Stand August 2010. DGHO-Leitlinie „MGUS“
- R. A. Kyle et al.: International Myeloma Working Group. Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma:IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. In: Leukemia, 2010, 24, S. 1121–1127. PMID 20410922
- Wikilite.com: Informationsseite zur Monoklonalen Gammopathie unbestimmter Signifikanz (MGUS) Englischsprachige Seite mit umfangreichen aktuellen Literaturangaben.
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b RA Kyle et al.: Review of 1027 patients with newly diagnosed multiple myeloma. In: Mayo Clin Proc. 78. Jahrgang, Nr. 1, Januar 2003, S. 21–33, doi:10.4065/78.1.21, PMID 12528874.
- ↑ a b A Dispenzieri et al.: Prevalence and risk of progression of light-chain monoclonal gammopathy of undetermined significance: a retrospective population-based cohort study. In: Lancet. 375. Jahrgang, Nr. 9727, 15. Mai 2010, S. 1721–1728, doi:10.1016/S0140-6736(10)60482-5, PMID 20472173.
- ↑ a b RA Kyle et al.: Prevalence of monoclonal gammopathy of undetermined significance. In: N Engl J Med. 354. Jahrgang, Nr. 13, 30. März 2006, S. 1362–1369, doi:10.1056/NEJMoa054494, PMID 16571879.
- ↑ onkopedia.com – Erstdiagnose eines Multiplen Myeloms – Leitlinien der DGHO, 21. Oktober 2012.
- ↑ a b c d e f g h N van de Donk et al.: The clinical relevance and management of monoclonal gammopathy of undetermined significance and related disorders: recommendations from the European Myeloma Network. In: Haematologica. 99. Jahrgang, Nr. 6, 21. März 2014, S. 984–96, doi:10.3324/haematol.2013.100552, PMID 23224402, PMC 4040895 (freier Volltext).
- ↑ A Dispenzieri et al.: International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. In: Leukemia. 23. Jahrgang, Nr. 2, 20. November 2008, S. 215–224, doi:10.1038/leu.2008.307, PMID 19020545.
- ↑ a b c SV Rajkumar et al.: International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. In: Lancet Oncology. 15. Jahrgang, November 2014, S. e538–e548, doi:10.1038/leu.2010.60, PMID 20410922.
- ↑ Steven P. Treon, Lian Xu, Guang Yang, Yangsheng Zhou, Xia Liu, Yang Cao, Patricia Sheehy, Robert J. Manning, Christopher J. Patterson, Christina Tripsas, Luca Arcaini, Geraldine S. Pinkus, Scott J. Rodig, Donald A. Skifter, Stephen E. Lincoln, Zachary R. Hunter: MYD88 L265P Somatic Mutation in Waldenström’s Macroglobulinemia. In: New England Journal. 2012, Band 367, Ausgabe 9 vom 30. August 2012, S. 826–833.
- ↑ RA Kyle et al.: A long-term study of prognosis in monoclonal gammopathy of undetermined significance. In: N Engl J Med. 346. Jahrgang, Nr. 8, 21. Februar 2002, S. 564–569, doi:10.1056/NEJMoa01133202, PMID 11856795.
- ↑ C Cesana et al.: Prognostic factors for malignant transformation in monoclonal gammopathy of undetermined significance and smoldering multiple myeloma. In: J Clin Oncol. 20. Jahrgang, Nr. 6, 15. März 2002, S. 1625–1634, doi:10.1200/JCO.2002.20.6.1625, PMID 11896113.
- ↑ J Bladé et al.: Pathogenesis and progression of monoclonal gammopathy of undetermined significance. In: Leukemia. 22. Jahrgang, Nr. 9, 26. März 2008, S. 1651–7, doi:10.1038/leu.2008.203, PMID 18668131.
- ↑ a b RA Kyle et al.: Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma:IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. In: Leukemia. 24. Jahrgang, 4. Februar 2010, S. 1121–1127, doi:10.1038/leu.2010.60, PMID 20410922.
- ↑ N Leung et al.: Monoclonal gammopathy of renal significance: when MGUS is no longer undetermined or insignificant. In: Blood. 120. Jahrgang, Nr. 22, 22. November 2012, S. 4292–4295, doi:10.1182/blood-2012-07-445304, PMID 23224402.
- ↑ JP Fermand et al.: How I treat monoclonal gammopathy of renal significance (MGRS). In: Blood. 122. Jahrgang, Nr. 22, 9. Oktober 2013, S. 3583–3590, doi:10.1182/blood-2013-05-495929, PMID 24108460.