„Bromtrichlormethan“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Jü (Diskussion | Beiträge) svg |
K Kleinkram |
||
| Zeile 1: | Zeile 1: | ||
{{Infobox Chemikalie |
{{Infobox Chemikalie |
||
| Strukturformel = [[Datei:Bromotrichloromethane FormulaV1.svg |
| Strukturformel = [[Datei:Bromotrichloromethane FormulaV1.svg|110px|Strukturformel von Bromtrichlormethan]] |
||
| Strukturhinweis = |
| Strukturhinweis = |
||
| Suchfunktion = CBrCl3 |
| Suchfunktion = CBrCl3 |
||
| Zeile 36: | Zeile 36: | ||
== Gewinnung und Darstellung == |
== Gewinnung und Darstellung == |
||
Bromtrichlormethan kann durch Reaktion von [[Tetrachlormethan]] mit [[Bromwasserstoff]] oder [[Aluminiumbromid]] gewonnen werden. Ebenfalls möglich ist die Gewinnung durch Reaktion von [[Trichlormethan]] mit [[Brom]] bei 225 °C bis 400 °C oder [[Kaliumtrichloracetat]] mit Brom bei 120 °C.<ref name="Thomas L. Gilchrist">{{Literatur |
Bromtrichlormethan kann durch Reaktion von [[Tetrachlormethan]] mit [[Bromwasserstoff]] oder [[Aluminiumbromid]] gewonnen werden. Ebenfalls möglich ist die Gewinnung durch Reaktion von [[Trichlormethan]] mit [[Brom]] bei 225 °C bis 400 °C oder [[Kaliumtrichloracetat]] mit Brom bei 120 °C.<ref name="Thomas L. Gilchrist">{{Literatur |Autor=Thomas L. Gilchrist |Titel=Comprehensive Organic Functional Group Transformations |Verlag=Elsevier |Datum=1995 |ISBN=0-08-042704-9 |Seiten=221 |Online={{Google Buch | BuchID=YzBveZGm0GEC | Seite=221 }}}}</ref> |
||
:<math>\mathrm{Cl_3CCO_2K + Br_2 \longrightarrow CBrCl_3 + CO_2 + KBr}</math> |
:<math>\mathrm{Cl_3CCO_2K + Br_2 \longrightarrow CBrCl_3 + CO_2 + KBr}</math> |
||
| Zeile 46: | Zeile 46: | ||
== Sicherheitshinweise == |
== Sicherheitshinweise == |
||
Bromtrichlormethan schädigt die Leber ähnlich wie Tetrachlormethan, ist jedoch stärker wirksam da die Abspaltung des Broms leichter erfolgt als die des Chlors.<ref>{{Literatur|Autor=Günter Fred Fuhrmann|Titel=Toxikologie für Naturwissenschaftler: Einführung in die Theoretische und Spezielle Toxikologie|Verlag=Springer-Verlag| |
Bromtrichlormethan schädigt die Leber ähnlich wie Tetrachlormethan, ist jedoch stärker wirksam da die Abspaltung des Broms leichter erfolgt als die des Chlors.<ref>{{Literatur |Autor=Günter Fred Fuhrmann |Titel=Toxikologie für Naturwissenschaftler: Einführung in die Theoretische und Spezielle Toxikologie |Verlag=Springer-Verlag |Datum=2006 |ISBN=3-8351-0024-6 |Online=[https://books.google.com/books?id=ylogBAAAQBAJ&q=Bromtrichlormethan books.google.com]}}</ref> |
||
== Einzelnachweise == |
== Einzelnachweise == |
||
Version vom 4. Juli 2016, 21:42 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
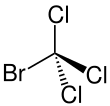
| ||||||||||
| Allgemeines | ||||||||||
| Name | Bromtrichlormethan | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | CBrCl3 | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 198,27 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig[1] | |||||||||
| Dichte |
2,01 g·cm−3[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
105 °C[1] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit | ||||||||||
| Brechungsindex |
1,5065 (20 °C)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Bromtrichlormethan ist eine chemische Verbindung aus der Gruppe der gesättigten Halogenmethane.
Gewinnung und Darstellung
Bromtrichlormethan kann durch Reaktion von Tetrachlormethan mit Bromwasserstoff oder Aluminiumbromid gewonnen werden. Ebenfalls möglich ist die Gewinnung durch Reaktion von Trichlormethan mit Brom bei 225 °C bis 400 °C oder Kaliumtrichloracetat mit Brom bei 120 °C.[4]
Eigenschaften
Bromtrichlormethan ist eine flüchtige, farblose Flüssigkeit mit stechendem Geruch, die praktisch unlöslich in Wasser ist.[1]
Verwendung
Bromtrichlormethan wird als Kettenübertragungsmittel für die radikalische Polymerisationen von Methacrylaten und als Bromierungsmittel verwendet.[3]
Sicherheitshinweise
Bromtrichlormethan schädigt die Leber ähnlich wie Tetrachlormethan, ist jedoch stärker wirksam da die Abspaltung des Broms leichter erfolgt als die des Chlors.[5]
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu CAS-Nr. 75-62-7 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ Eintrag zu ' in der Hazardous Substances Data Bank (via PubChem)
- ↑ a b Datenblatt Bromotrichloromethane, 99% bei Sigma-Aldrich (PDF).
- ↑ Thomas L. Gilchrist: Comprehensive Organic Functional Group Transformations. Elsevier, 1995, ISBN 0-08-042704-9, S. 221 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Günter Fred Fuhrmann: Toxikologie für Naturwissenschaftler: Einführung in die Theoretische und Spezielle Toxikologie. Springer-Verlag, 2006, ISBN 3-8351-0024-6 (books.google.com).

