„Diphensäure“ – Versionsunterschied
| [gesichtete Version] | [ungesichtete Version] |
Römpp |
Vielleicht gehts so |
||
| Zeile 44: | Zeile 44: | ||
{{Überarbeiten|grund=[[Vorlage:Literatur]]}} |
{{Überarbeiten|grund=[[Vorlage:Literatur]]}} |
||
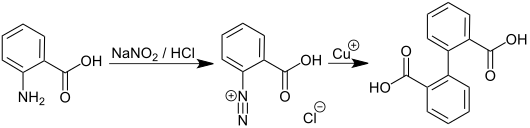
Wird Phenantharen mit [[Oxidationsmittel]]n (z. B. ''[[Wasserstoffperoxid]]'', ''[[Chrom(VI)-oxid]]'', ''[[Kaliumdichromat]]'' , ''[[Kaliumpermanganat]]'') behandelt, entsteht [[9,10-Phenanthrenchinon]] und durch weitere [[Oxidation]] Diphensäure.<ref>C.R. Noller: ''Lehrbuch der Organischen Chemie'', Springer-Verlag, 1960, ISBN 978-3-642-87325-6 , S. 635, {{doi|10.1007/978-3-642-87324-9}}</ref> |
|||
| ⚫ | |||
| ⚫ | Kocht man 9,10-Phenanthrenchinon mit [[Alkoholisches Kali|alkoholischem Kali]], so entsteht Diphensäure.<ref>Gustav Schultz: ''Die Chemie des Steinkohlentheers: Bd. Die Rohmaterialen'', Friedrich Vieweg und Sohn, 1886.</ref><ref>Dr. Hans Meyer: ''Synthese der Kohlenstoffverbindungen: Erster Teil: Offene Ketten und Isocyclen'', Springer-Verlag, 1938, ISBN 978-3-7091-3245-6, S. 1170.</ref> |
||
Auch ensteht durch [[Photooxidation]] aus 9,10-Phenanthrenchinon die Diphensäure.<ref>A. Coehn, G. Jung, J. Daimer: ''Photochemie und Photographische Chemikalienkunde'', Springer Vienna, 1926, ISBN 978-3-7091-5255-3, S. 136, {{doi|10.1007/978-3-7091-5403-8}}</ref> |
|||
==Verwendung== |
|||
Die Diphensäure kann zur Herstellung von [[Polyesterharz |Polyester]]- und [[Alkydharze]]n dienen.<ref>Heinz-Gerhard Franck, Jürgen W. Stadelhofer: ''Industrielle Aromatenchemie: Rohstoffe-Verfahren-Produkte'', Springer Berlin Heidelberg , 1987, ISBN 9783662078754, S. 377, {{doi| 10.1007/978-3-662-07875-4}}</ref> |
|||
== Einzelnachweise == |
== Einzelnachweise == |
||
Version vom 9. August 2016, 01:27 Uhr
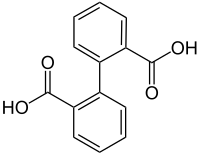
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Diphensäure | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C14H10O4 | |||||||||
| Kurzbeschreibung |
grauweißes Pulver, monokline Prismen oder Plättchen, Nadeln[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 242,23 g·mol−1[2] | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
1,2917 g·cm–3[3] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[4], löslich in organische Lösungsmitteln[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Diphensäure (HOOCC6H4C6H4COOH) ist ein aromatische chemische Verbindung. Die Struktur besteht aus zwei Benzolringen mit je einer in ortho-Stellung angefügten Carboxygruppe (–COOH). Die Säure bildet ein inneres Anhydrid mit einem an die beiden Benzolringe anellierten siebengliedrigen Ring; das Anhydrid besitzt einen Schmelzpunkt von 219 °C.[5]

Gewinnung und Darstellung
- Aus Anthranilsäure durch Diazotierung und anschließende Einwirkung von Kupfer(I)-Ionen:[6]
- Aus Phenanthren:[7]
Zuerst Gewinnung von Peroxyessigsäure aus Essigsäure und 90 % Wasserstoffperoxid:
Peroxyessigsäure + Phenanthren → Diphensäure + Essigsäure
Wird Phenantharen mit Oxidationsmitteln (z. B. Wasserstoffperoxid, Chrom(VI)-oxid, Kaliumdichromat , Kaliumpermanganat) behandelt, entsteht 9,10-Phenanthrenchinon und durch weitere Oxidation Diphensäure.[8]
Kocht man 9,10-Phenanthrenchinon mit alkoholischem Kali, so entsteht Diphensäure.[9][10]
Auch ensteht durch Photooxidation aus 9,10-Phenanthrenchinon die Diphensäure.[11]
Verwendung
Die Diphensäure kann zur Herstellung von Polyester- und Alkydharzen dienen.[12]
Einzelnachweise
- ↑ a b c Eintrag zu Diphensäure. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c d e Datenblatt Diphenic acid bei Sigma-Aldrich (PDF).
- ↑ Carl Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, William Andrew, 20. Juni 2014, ISBN 978-0-323-29060-9, S. 325.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 96. Auflage. CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-48.
- ↑ D'Ans-Lax: Taschenbuch für Chemiker und Physiker. 4. Auflage, Band 2, Springer Verlag 1982, ISBN 3-540-12263-X.
- ↑ E. R. Atkinson, H. J. Lawler.: Diphenic Acid In: Organic Syntheses. 7, 1927, S. 30, doi:10.15227/orgsyn.007.0030; Coll. Vol. 1, 1941, S. 222 (PDF).
- ↑ William F. O’Connor, Emil J. Moriconi: 2,2′-Diphenic Acid from Phenanthrene. In: Industrial & Engineering Chemistry. Band 45, Nr. 2, 1953, S. 277–281, doi:10.1021/ie50518a020.
- ↑ C.R. Noller: Lehrbuch der Organischen Chemie, Springer-Verlag, 1960, ISBN 978-3-642-87325-6 , S. 635, doi:10.1007/978-3-642-87324-9
- ↑ Gustav Schultz: Die Chemie des Steinkohlentheers: Bd. Die Rohmaterialen, Friedrich Vieweg und Sohn, 1886.
- ↑ Dr. Hans Meyer: Synthese der Kohlenstoffverbindungen: Erster Teil: Offene Ketten und Isocyclen, Springer-Verlag, 1938, ISBN 978-3-7091-3245-6, S. 1170.
- ↑ A. Coehn, G. Jung, J. Daimer: Photochemie und Photographische Chemikalienkunde, Springer Vienna, 1926, ISBN 978-3-7091-5255-3, S. 136, doi:10.1007/978-3-7091-5403-8
- ↑ Heinz-Gerhard Franck, Jürgen W. Stadelhofer: Industrielle Aromatenchemie: Rohstoffe-Verfahren-Produkte, Springer Berlin Heidelberg , 1987, ISBN 9783662078754, S. 377, doi:10.1007/978-3-662-07875-4