„Isopulegole“ – Versionsunterschied
| [ungesichtete Version] | [ungesichtete Version] |
Keine Bearbeitungszusammenfassung |
→Anwendungen: More to come |
||
| Zeile 76: | Zeile 76: | ||
== Anwendungen == |
== Anwendungen == |
||
=== Verwendung in der Riechstoff- und Nahrungsmittelindustrie === |
|||
| ⚫ | (−)-Isopulegol |
||
(−)-Isopulegol besitzt ähnliche Kühlwirkung wie [[Menthol]].<ref name=Legrum>Wolfgang Legrum: ''Riechstoffe, zwischen Gestank und Duft'', Vieweg + Teubner Verlag (2011) S. 16−18, ISBN 978-3-8348-1245-2.</ref> |
|||
=== Verwendung in der Synthese von Naturstoffen === |
|||
| ⚫ | (−)-Isopulegol wird auch zur Herstellung von anderen synthetischen Naturstoffen, beispielsweise Aromastoffen, verwendet, insbesondere optisch aktive Menthol-Stereoisomere durch katalytische Hydrierung der Kohlenstoff-Kohlenstoff-Doppelbindung in Isopulegol. Auch [[Menthofurane]] (wie sie in der Pfefferminzpflanze vorkommen) und der Süßstoff [[Hernandulcin]], der vor allem in der Pflanze ''[[Lippia dulcis]]'' vorkommt, können aus Isopulegol hergestellt werden. |
||
Schmid und Hofheinz synthetisierten bereits 1982, ausgehend von (−)-Isopulegol, in acht Syntheseschritten das [[Terpene|Sesquiterpen]] [[Artemisinin]],<ref>{{cite book|title=Fortschritte der Chemie organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products|url=http://books.google.com/books?id=0x_pCAAAQBAJ&pg=PA129|date=6 December 2012|publisher=Springer Science & Business Media|isbn=978-3-7091-6527-0|pages=129 f}}</ref> das zur Behandlung von Infektionen mit multiresistenten Stämmen von ''[[Plasmodium falciparum]]'', dem Erreger der [[Malaria|Malaria tropica]], eingesetzt wird. |
|||
== Eigenschaften der verschiedenen Isomere == |
== Eigenschaften der verschiedenen Isomere == |
||
Version vom 11. Juni 2016, 11:02 Uhr
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Strukturformel ohne Stereochemie | ||||||||||
| Allgemeines | ||||||||||
| Name | Isopulegole | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C10H18O | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 154,25 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig[1] | |||||||||
| Dichte |
0,912 g·cm−3 (25 °C)[1] | |||||||||
| Siedepunkt |
212 °C[1] | |||||||||
| Löslichkeit | ||||||||||
| Brechungsindex | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Isopulegol zählt zu den Monoterpenen und wird wie die Terpineole zu den p-Menthenolen gezählt.[4]
Die Molekülstruktur besitzt drei Chiralitätszentren – die Kohlenstoffatome in den Positionen 1 (Hydroxygruppe), 2 (Isopropenylgruppe) und 5 (Methylgruppe) des Cyclohexan-Rings – was zu acht Stereoisomeren führt (d. h. je zwei Enantiomere von vier verschiedenen Diastereomeren):
- (+)- und (–)-Isopulegol,
- (+)- und (–)-Iso-Isopulegol,
- (+)- und (–)-Neo-Isopulegol und
- (+)- und (–)-Neoiso-Isopulegol;
alle acht Verbindungen sind farblose Flüssigkeiten.
Vorkommen
(–)-Isopulegol

(–)-Isopulegol – der Naturstoff ist linksdrehend; deshalb auch in der englischen Literatur die Bezeichnung „l-Isopulegol“ – findet sich in Ölen von Zitronengras (Cymbopogon citratus),[5] „East African Geranium“ (vermutlich Pelargonium graveolens[6]),[5] Zitroneneukalyptus (Corymbia citriodora)[5][7] und Rundblättriger Minze.[4]
(–)-Isopulegol wurde auch erstmalig in einem Pilz, dem Pflanzen schädigenden Schlauchpilz Ceratocystis coerulescens RWD 451, in Zellkultur nachgewiesen.[8]
(+)-Isopulegol
(+)-Isopulegol – der Naturstoff ist rechtsdrehend; deshalb auch in der englischen Literatur die Bezeichnung „d-Isopulegol“ – findet sich in Backhousia citriodora[9][10] und Baeckea citriodora.[10]
(+)-Neo-Isopulegol
(+)-Neoisopulegol wurde in Mentha rotundifolia (Lamiaceae) nachgewiesen[4] und ist auch eine der Komponenten im Eucalyptus-citriodora-Öl.[11]
(+)-Neoiso-Isopulegol
(+)-Neoiso-isopulegol wurde erstmals 1960 aus dem Minzöl der Rundblättrigen Minze (Mentha rotundifolia) isoliert.[12]
Natürliche Gewinnung und Synthese

Natürliche Gewinnung
Isopulegol kann aus einer Vielzahl von Pflanzen gewonnen werden, beispielsweise aus den ätherischen Ölen von Eucalyptus citriodora[13] oder Zitronengras.[14]
Synthese
Die Erstbenennung erfolgte 1896 durch Ferdinand Tiemann und R. Schmidt bei der systematischen Untersuchung der Reaktionen von Citronellal:[15] „Ein cyclischer Alkohol, welchen wir vorläufig als Isopulegol bezeichnen, wird aus Citronellal unter folgenden Bedingungen[16] erhalten...“ Als Struktur für dieses „Isopulegol“ wird im Artikel aber die Struktur von Pulegol angegeben.
Synthetisch kann der Stoff durch katalytische Cyclisierung (intramolekulare Prins-Reaktion von Citronellal, auch intramolekulare Carbonyl-En-Reaktion genannt) gewonnen werden.[17][18] Durch die Wahl eines geeigneten Katalysators kann die Selektivität der Reaktion für ein oder mehrere Stereoisomere von Isopulegol erhöht werden. Typische Katalysatoren sind Lewis-Säuren auf Basis von Aluminium oder Siliciumverbindungen, einschließlich Zeolithe wie Clinoptilolith.[19]
Eigenschaften
Optisch und chemisch hochreines (≥ 99.7 %) (−)-Isopulegol ist geruchslos, bewirkt aber bei Zugabe zu Zitrusgerüchen eine Kühlwirkung (wirkt als flavour/sensory enhancer).[20]
Anwendungen
Verwendung in der Riechstoff- und Nahrungsmittelindustrie
(−)-Isopulegol besitzt ähnliche Kühlwirkung wie Menthol.[21]
Verwendung in der Synthese von Naturstoffen
(−)-Isopulegol wird auch zur Herstellung von anderen synthetischen Naturstoffen, beispielsweise Aromastoffen, verwendet, insbesondere optisch aktive Menthol-Stereoisomere durch katalytische Hydrierung der Kohlenstoff-Kohlenstoff-Doppelbindung in Isopulegol. Auch Menthofurane (wie sie in der Pfefferminzpflanze vorkommen) und der Süßstoff Hernandulcin, der vor allem in der Pflanze Lippia dulcis vorkommt, können aus Isopulegol hergestellt werden.
Schmid und Hofheinz synthetisierten bereits 1982, ausgehend von (−)-Isopulegol, in acht Syntheseschritten das Sesquiterpen Artemisinin,[22] das zur Behandlung von Infektionen mit multiresistenten Stämmen von Plasmodium falciparum, dem Erreger der Malaria tropica, eingesetzt wird.
Eigenschaften der verschiedenen Isomere
| Isopulegole | ||||||||||
| Name | (+)-Isopulegol | (–)-Isopulegol | (+)-Iso-Isopulegol | (–)-Iso-Isopulegol | (+)-Neo-Isopulegol | (–)-Neo-Isopulegol | (+)-Neo-Iso-Isopulegol | (–)-Neo-Iso-Isopulegol | ||
| Andere Namen | (1S,2R,5S)-2-Isopropenyl-5-methylcyclohexanol | (1R,2S,5R)-2-Isopropenyl-5-methylcyclohexanol | (1S,2R,5R)-2-Isopropenyl-5-methylcyclohexanol | (1R,2S,5S)-2-Isopropenyl-5-methylcyclohexanol | (1S,2S,5R)-2-Isopropenyl-5-methylcyclohexanol | (1R,2R,5S)-2-Isopropenyl-5-methylcyclohexanol | (1R,2R,5R)-2-Isopropenyl-5-methylcyclohexanol | (1S,2S,5S)-2-Isopropenyl-5-methylcyclohexanol | ||
| Strukturformel | 
|

|

|
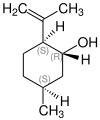
|

|

|

|

| ||
| CAS-Nummer | 104870-56-6 | 89-79-2 | 96612-21-4 | 18674-65-2 | 20549-46-6 ?? 21290-09-5 ?? |
144541-38-8 | ||||
| PubChem | 1268090 | 170833 | 11008146 | 6553885 | ||||||
| Summenformel | C10H18O | |||||||||
| Molare Masse | 154,25 g·mol−1 | |||||||||
| Aggregatzustand | flüssig | |||||||||
| Kurzbeschreibung | farblose Flüssigkeiten | |||||||||
| Siedepunkt | 91 °C bei 16 hPa[23] | 212 °C[24] | ||||||||
| Löslichkeit | ||||||||||
| GHS- Kennzeichnung |
|
|
||||||||
| H-Sätze | 302‐315‐319‐335[23] | 302‐315‐319‐335[24] | ||||||||
| P-Sätze | 301+312+330‐305+351+338[23] | 261‐305+351+338[24] | ||||||||
Einzelnachweise
- ↑ a b c d e f g Datenblatt (−)-Isopulegol, 99% bei Sigma-Aldrich (PDF).
- ↑ Richard J. Lewis: Food Additives Handbook. Springer Science & Business Media, 1989, ISBN 978-0-442-20508-9, S. 294 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Datenblatt (+)-Isopulegol, 99% bei Sigma-Aldrich (PDF).
- ↑ a b c Eintrag zu p-Menthenole. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c Thomas E. Furia: Fenaroli's Handbook of Flavor Ingredients. Taylor & Francis, 1971, ISBN 978-0-87819-533-6, S. 311 (google.com).
- ↑ Ernest Guenther: The essential oils. D. Van Nostrand Co., 1950, S. 729 (google.com).
- ↑ Eintrag zu Eucalyptusöle. In: Römpp Online. Georg Thieme Verlag
- ↑ Wolf-Gerald Koch und Volker Sinnwell: Isopulegol from Liquid Cultures of the Fungus Ceratocystis coerulescens (Ascomycotina), Zeitschrift für Naturforschung C, Bd. 42, Nr. 1-2 (Februar 1987); abgerufen am 9. Juni 2016.
- ↑ A. R. Penfold, F. R. Morrison, J. L. Willis, H. H. G. McKern und M. C. Spies: The occurence of a physiological form of Backhousia citriodora F. Muell and its essential oil, J. Proc. Roy. Soc. N.S. Wales 85, 123-126 (1952).
- ↑ a b D. L. J. Opdyke: Monographs on Fragrance Raw Materials: A Collection of Monographs Originally Appearing in Food and Cosmetics Toxicology. Elsevier, 2013, ISBN 978-1-4831-4797-0, S. 473 (google.com).
- ↑ Römpp-Lexikon: Eucalyptusöle; abgerufen am 9. Juni 2016.
- ↑ Sumio Shimizua, Nagamori Ikedaa und Hiroo Uedaa: Isolation of (+)-Neoiso-isopulegol, a New Stereoisomer of Isopulegol and Piperitenone from a Variety of Mentha rotundifolia', Bull. of the Agricult. Chem. Soc. Japan, Bd. 24, Nr. 3 (1960); [DOI 10.1080/03758397.1960.10857672]; abgerufen am 9. Juni 2016).
- ↑ B. R. Rajeswara Rao, P. N. Kaul, K. V. Syamasundar, S. Ramesh, Flavour and Fragrance Journal (2003), 18, S. 133–135.
- ↑ Raquel G. Jacob et al.: Green synthesis of (−)-isopulegol from (+)-citronellal: application to essential oil of citronella, Tetrahedron Letters Vol. 44 Nr. 18 (2003), S. 3605–3608, doi:10.1016/S0040-4039(03)00714-7.
- ↑ Ferdinand Tiemann und R. Schmidt: Ueber die Verbindungen der Citronellalreihe. In: Berichte. Band 29, Nr. 1, Januar 1896, S. 903–926, doi:10.1002/cber.189602901175 (PDF).
- ↑ Die angegebenen Bedingungen waren: Erhitzen von Citronellal mit Essigsäureanhydrid und anschliessende Verseifung des durch Destillation aufgereinigten Essigsäureesters.
- ↑ U.S. Patent 2117463: Method of producing isopulegol vom 17. Mai 1938 an Charles O. Terwilliger
- ↑ Kelly A. da Silva et al.: Cyclization of (+)-citronellal to (−)-isopulegol catalyzed by H3PW12O40/SiO2, Catalysis Communications Vol. 5 Nr. 8 (2004), S. 425–429; doi:10.1016/j.catcom.2004.05.001.
- ↑ Mercedes Fuentes et al.: Cyclization of Citronellal to Isopulegol by Zeolite Catalysis, Applied Catalysis, vol. 47 nr. 2 (1989), S. 367–374; doi:10.1016/S0166-9834(00)83242-X.
- ↑ Takeshi Yamamoto (Takasago International Corporation, Tokyo, Japan): United States Patent 5,773,410 (30. Juni 1998), Method for purifying (-)-N-isopulegol and citrus perfume composition containing (-)-N-isopulegol obtained by the method ; abgerufen am 8. Juni 2016.
- ↑ Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 16−18, ISBN 978-3-8348-1245-2.
- ↑ Fortschritte der Chemie organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products. Springer Science & Business Media, 2012, ISBN 978-3-7091-6527-0, S. 129 f. (google.com).
- ↑ a b c d Datenblatt (+)-Isopulegol, 99% bei Sigma-Aldrich (PDF).
- ↑ a b c d Datenblatt (−)-Isopulegol, 99% bei Sigma-Aldrich (PDF).
