„Sesquiterpenlactone“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Keine Bearbeitungszusammenfassung |
Der Artikel wurde verbessert und erweitert. |
||
| Zeile 1: | Zeile 1: | ||
'''Sesquiterpenlactone''' sind natürlich vorkommende [[Terpene|Terpenderivate]], genauer gesagt [[Sesquiterpenderivate]], die eine [[Lacton]]-Funktion aufweisen, an der sie häufig eine exocyclische [[Methylengruppe]] besitzen.<ref>{{Literatur |Autor=Nikolaus H. Fischer |Titel=Sesquiterpene Lactones: Biogenesis and Biomimetic Transformations |Sammelwerk=Biochemistry of the Mevalonic Acid Pathway to Terpenoids |Verlag=Springer US |Ort=Boston, MA |Datum=1990 |ISBN=9781468487916 |DOI=10.1007/978-1-4684-8789-3_4 |Seiten=161–201 |Online=https://link.springer.com/chapter/10.1007%2F978-1-4684-8789-3_4 |Abruf=2018-09-21}}</ref> Es sind fast 5000 Vertreter dieser Stoffgruppe bekannt die sich als [[Sekundärmetabolit|Sekundärmetaboliten]] in vielen Pflanzen, vor allem in Vertretern der Familie der [[Korbblütler]] (''Asteraceae''), finden lassen. Sie können unter anderem als [[Taxonomie|taxonomisches]] Merkmal für ''Asteraceae'' verwendet werden.<ref name="Schmidt">Thomas J. Schmidt: ''Toxic Activities of Sesquiterpene Lactones – Structural and Biochemical Aspects''. In: ''Current Organic Chemistry'' 3, 1999, S. 577–605; [https://www.researchgate.net/publication/283889985_Toxic_activities_of_sesquiterpene_lactones_Structural_and_biochemical_aspects Abstract].</ref> Sesquiterpenlactone spielen eine wichtige Rolle in der Abwehr von Fraßfeinden der Pflanzen, sie wirken hormonartig und sind als bioaktive Substanzen von medizinischem Interesse. |
|||
| ⚫ | |||
'''Sesquiterpenlactone''' sind natürliche [[Terpene|Sesquiterpenderivate]], die eine [[Lacton]]-Funktion aufweisen. Es sind über 4000 Vertreter dieser Stoffgruppe bekannt, die sich als [[Sekundärmetabolit]]en in vielen Pflanzen, vor allem in Vertretern der Familie der [[Korbblütler]] (''Asteraceae'') finden.<ref name="Schmidt">Thomas J. Schmidt: ''Toxic Activities of Sesquiterpene Lactones – Structural and Biochemical Aspects''. In: ''Current Organic Chemistry'' 3, 1999, S. 577–605; [https://www.researchgate.net/publication/283889985_Toxic_activities_of_sesquiterpene_lactones_Structural_and_biochemical_aspects Abstract].</ref> Sie fungieren dort vor allem als Abwehrstoffe. Diese Funktion wird einerseits durch ihren bitteren Geschmack und andererseits durch Eingriff in den [[Stoffwechsel]] anderer Organismen erfüllt. Die verschiedenen Sesquiterpenlactone wirken unter anderem toxisch auf Bakterien, Pilze, Würmer und andere Parasiten, aber auch auf Säugetiere. Allerdings haben einige Vertreter auch Eigenschaften, die sie zu einem interessanten Objekt für die pharmakologische Forschung machen, wie etwa eine migräne- oder entzündungshemmende Wirkung. Einige dieser Wirkungen macht man sich in der traditionellen Medizin bereits seit Jahrhunderten zu Nutze. |
|||
| ⚫ | |||
So ist etwa die entzündungshemmende Wirkung der ''[[Arnica montana]]'', die in Europa seit dem Mittelalter als Heilpflanze bekannt ist, auf Sesquiterpenlactone zurückzuführen. Ebenso die Wirkungen der ''[[Mikania]] micrantha'', die in Mittel- und Südamerika beheimatet ist, und der ''[[Saussurea]] lappa'', der in Asien vorkommt. Der entzündungshemmende Effekt dieser Sesquiterpenlactone ist auf eine Hemmung von [[Transkriptionsfaktor]]en wie [[NF-κB]] und [[AP-1]] zurückzuführen.<ref name="Wagner">Steffen Wagner: ''Sesquiterpenlactone: Neuronale Netze als QSAR-Modell sowie pharmakokinetische Untersuchungen am Beispiel von Arnica montana''. Dissertation, 2006. [http://www.freidok.uni-freiburg.de/volltexte/2560/ PDF; 6,03 MB].</ref> |
|||
== Aufbau == |
|||
| ⚫ | |||
Der grundlegende Aufbau von Terpenen besteht aus [[Isopren]]-Einheiten. Das sind C5-Körper (5 Kohlenstoff Atome) deren Anzahl und Anordnung je nach Terpentyp variiert.<ref>{{Literatur |Autor=L. Ruzicka |Titel=The isoprene rule and the biogenesis of terpenic compounds |Sammelwerk=Experientia |Band=9 |Nummer=10 |Datum=1953-10 |ISSN=0014-4754 |DOI=10.1007/bf02167631 |Seiten=357–367 |Online=https://link.springer.com/article/10.1007%2FBF02167631 |Abruf=2018-09-21}}</ref> Sesquiterpene bestehen aus drei Isopren-Einheiten und besitzen demnach ein C15-Gundgerüst. Man nimmt an, dass der [[Biosynthese|Biosyntheseweg]] über den cytosolischen [[Mevalonatweg]] verläuft und [[Farnesylpyrophosphat]] eine Sesquiterpen-Vorstufe darstellt.<ref>{{Literatur |Autor=Helga D. Fischer, N. H. Fischer, R. W. Franck, E. J. Olivier |Titel=Fortschritte der Chemie organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products |Sammelwerk=Fortschritte der Chemie organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products |Datum=1979 |ISSN=0071-7886 |DOI=10.1007/978-3-7091-8548-3 |Online=https://link.springer.com/book/10.1007%2F978-3-7091-8548-3 |Abruf=2018-09-21}}</ref> Sesquiterpenlactone unterliegen einer Klassifizierung aufgrund der Anordnung ihres Kohlenstoffgrundgerüstes. So gibt es z.B. die Klasse der Xanthanolide, zu der unter anderem [[Tomentosin]] und [[8-Epixanthatin]] gehören, die Klasse der Guaianolide, vertreten z.B. durch [[Dehydrocostuslacton]], und die Klasse der Germacranolide mit [[Costunolid]] als Exempel.<ref>{{Literatur |Autor=Frederick C. Seaman |Titel=Sesquiterpene lactones as taxonomic characters in the asteraceae |Sammelwerk=The Botanical Review |Band=48 |Nummer=2 |Datum=1982-04 |ISSN=0006-8101 |DOI=10.1007/bf02919190 |Seiten=121–594 |Online=https://link.springer.com/article/10.1007%2FBF02919190 |Abruf=2018-09-21}}</ref> |
|||
== Funktionen == |
|||
Die exocyclische Methylengruppe am γ-Lactonring der Sesquiterpenlactone führt durch ihre hohe [[Nukleophilie|nukleophile]] Reaktivität zu einer starken biologischen Aktivität der Verbindungen. Aufgrund dessen kommt es unter anderem zu Reaktionen mit [[Thiolgruppe|Thiolgruppen]], so z.B. der Thiolgruppe der Aminosäure [[Cystein]], was einen Einfluss der Verbindungen auf Proteine ermöglicht.<ref>{{Literatur |Autor=Otmar Spring, Achim Hager |Titel=Inhibition of elongation growth by two sesquiterpene lactones isolated from Helianthus annuus L. |Sammelwerk=Planta |Band=156 |Nummer=5 |Datum=1982-12 |ISSN=0032-0935 |DOI=10.1007/bf00393314 |Seiten=433–440 |Online=https://link.springer.com/article/10.1007%2FBF00393314 |Abruf=2018-09-21}}</ref> Das Funktions- und Wirkungsspektrum der Sesquiterpenlactone ist sehr breit. Sie besitzen z.B. [[Antimykotikum|antimykotische]], [[Antibakteriell|antibakterielle]], [[Zytotoxizität|zytotoxische]], antitumorale, [[Antiinflammatorisch|antiinflammatorische]] und [[Allelopathie|allelopathische]] Eigenschaften. Auch für Säugetiere wie den Menschen können diese Substanzen toxisch sein, da sie zu [[Kontaktdermatitis]] führen können.<ref>{{Literatur |Autor=Anna K. Picman |Titel=Biological activities of sesquiterpene lactones |Sammelwerk=Biochemical Systematics and Ecology |Band=14 |Nummer=3 |Datum=1986-05 |ISSN=0305-1978 |DOI=10.1016/0305-1978(86)90101-8 |Seiten=255–281 |Online=https://linkinghub.elsevier.com/retrieve/pii/0305197886901018 |Abruf=2018-09-21}}</ref> Für Pflanzen fungieren sie vor allem als Abwehrstoffe gegen [[Herbivore]] und [[Mikroorganismus|Mikroorganismen]]. Diese Funktion wird einerseits durch ihren bitteren Geschmack und andererseits durch die Zytotoxizität, z.B. durch Eingriffe in den [[Stoffwechsel]] der [[Pathogene]], erfüllt. Zur Abwehrzwecken werden sie in spezialisierten Zellen, den [[Trichom|köpfchentragenden Drüsenhaaren]], auf den Oberflächen der Pflanzen gebildet und in [[Cuticula (Pflanzen)|Kutikularblasen]] sekretiert.<ref>{{Literatur |Autor=Otmar Spring, Uta Bienert, Volker Klemt |Titel=Sesquiterpene Lactones in Glandular Trichomes of Sunflower Leaves |Sammelwerk=Journal of Plant Physiology |Band=130 |Nummer=4-5 |Datum=1987-10 |ISSN=0176-1617 |DOI=10.1016/s0176-1617(87)80208-0 |Seiten=433–439 |Online=https://linkinghub.elsevier.com/retrieve/pii/S0176161787802080 |Abruf=2018-09-21}}</ref> |
|||
== Sesquiterpenlactone als Pflanzenhormone == |
|||
Neben der Verteidigung der Pflanzen gegen Pathogene und Herbivore haben Sesquiterpenlactone offensichtlich auch hormonelle Wirkungen. Die vier Sesquiterpenlactone Tomentosin, 8-Epixanthatin, Dehydrocostuslacton und Costunolid wurden innerhalb der Pflanzengewebe nachgewiesen. Sie kommen nicht in den Trichomen auf der Pflanzenoberfläche vor und sind um ein vielfaches geringer konzentriert als die in den Trichomen lokalisierten Verbindungen.<ref>{{Literatur |Autor=Frank M. Raupp, Otmar Spring |Titel=New Sesquiterpene Lactones from Sunflower Root Exudate as Germination Stimulants for Orobanche cumana |Sammelwerk=Journal of Agricultural and Food Chemistry |Band=61 |Nummer=44 |Datum=2013-10-24 |ISSN=0021-8561 |DOI=10.1021/jf402392e |Seiten=10481–10487 |Online=https://pubs.acs.org/doi/10.1021/jf402392e |Abruf=2018-09-21}}</ref> Innerhalb der Pflanzengewebe wird eine physiologische Funktion der Sesquiterpenlactone als [[Inhibitor|Inhibierung]] des [[Auxine|Auxin]]-abhängigen [[Streckungswachstum|Streckungswachstums]] angenommen.<ref>{{Literatur |Autor=Otmar Spring, Achim Hager |Titel=Inhibition of elongation growth by two sesquiterpene lactones isolated from Helianthus annuus L. |Sammelwerk=Planta |Band=156 |Nummer=5 |Datum=1982-12 |ISSN=0032-0935 |DOI=10.1007/bf00393314 |Seiten=433–440 |Online=https://link.springer.com/article/10.1007%2FBF00393314 |Abruf=2018-09-21}}</ref><ref>{{Literatur |Autor=Kaori Yokotani-Tomita, Jun Kato, Seiji Kosemura, Shosuke Yamamura, Midori Kushima |Titel=Light-induced auxin-inhibiting substance from sunflower seedlings |Sammelwerk=Phytochemistry |Band=46 |Nummer=3 |Datum=1997-10 |ISSN=0031-9422 |DOI=10.1016/s0031-9422(97)00307-5 |Seiten=503–506 |Online=https://linkinghub.elsevier.com/retrieve/pii/S0031942297003075 |Abruf=2018-09-21}}</ref> Gestützt wird diese These durch Versuche, bei denen gezeigt wurde, dass während einer einseitigen Belichtung von Sonnenblumen [[Hypokotyl|Hypokotylen]] keine differenzierte Verteilung von Auxin stattfindet.<ref>{{Literatur |Autor=J. BRUINSMA, C.M. KARSSEN, M. BENSCHOP, J.B. VAN DORT |Titel=Hormonal Regulation of Phototropism in the Light-grown Sunflower Seedling,Helianthus annuusL.: Immobility of Endogenous Indoleacetic Acid and Inhibition of Hypocotyl Growth by Illuminated Cotyledons |Sammelwerk=Journal of Experimental Botany |Band=26 |Nummer=3 |Datum=1975 |ISSN=0022-0957 |DOI=10.1093/jxb/26.3.411 |Seiten=411–418 |Online=https://academic.oup.com/jxb/article-abstract/26/3/411/605604?redirectedFrom=fulltext |Abruf=2018-09-21}}</ref> Daraus wurde geschlossen, dass Auxininhibitoren auf der belichteten Seite für die Krümmungsreaktion der Pflanzen verantwortlich sein müssten.<ref>{{Literatur |Autor=Martin Feyerabend, Elmar W. Weiler |Titel=Immunological estimation of growth regulator distribution in phototropically reacting sunflower seedlings |Sammelwerk=Physiologia Plantarum |Band=74 |Nummer=1 |Datum=1988-09 |ISSN=0031-9317 |DOI=10.1111/j.1399-3054.1988.tb04962.x |Seiten=185–193 |Online=https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1399-3054.1988.tb04962.x |Abruf=2018-09-21}}</ref><ref>{{Literatur |Autor=Johan Bruinsma, Koji Hasegawa |Titel=A new theory of phototropism - its regulation by a light-induced gradient of auxin-inhibiting substances |Sammelwerk=Physiologia Plantarum |Band=79 |Nummer=4 |Datum=1990-08 |ISSN=0031-9317 |DOI=10.1111/j.1399-3054.1990.tb00047.x |Seiten=700–704 |Online=https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1399-3054.1990.tb00047.x |Abruf=2018-09-21}}</ref> Zudem wurde eine abwärts gerichtete [[Diffusion|Diffusionsrichtung]] der Verbindungen nachgewiesen.<ref>{{Literatur |Autor=SHIBAOKA, HIROH |Titel=STUDIES ON THE MECHANISM OF GROWTH INHIBITING EFFECT OF LIGHT |Sammelwerk=Plant and Cell Physiology |Band=2 |Nummer=2 |Datum=1961-05 |ISSN=1471-9053 |DOI=10.1093/oxfordjournals.pcp.a077675 |Online=https://academic.oup.com/pcp/article-abstract/2/2/175/1893860?redirectedFrom=fulltext |Abruf=2018-09-21}}</ref> Daher kann nicht ausgeschlossen werden, dass Sesquiterpenlactone, aufgrund ihrer Eigenschaft an Thiolgruppen binden zu können, mit Proteinen der AUXIN RESISTANT1- und/oder der PIN-Familie interagieren können, und so den polaren Auxin-Transport beeinflussen könnten, der treibende Kraft hinter [[Phototropismus]] und [[Gravitropismus]] ist. Die Hemmung des abwärts gerichteten Auxintransports wurde experimentell durch Applikation von Dehydrocostuslacton an Hypokotylen von ''[[Rettiche|Raphanus]]'' gezeigt.<ref>{{Literatur |Autor=Junichi Ueda, Yuta Toda, Kiyotaka Kato, Yuichi Kuroda, Tsukasa Arai |Titel=Identification of dehydrocostus lactone and 4-hydroxy-β-thujone as auxin polar transport inhibitors |Sammelwerk=Acta Physiologiae Plantarum |Band=35 |Nummer=7 |Datum=2013-03-29 |ISSN=0137-5881 |DOI=10.1007/s11738-013-1261-6 |Seiten=2251–2258 |Online=https://link.springer.com/article/10.1007%2Fs11738-013-1261-6 |Abruf=2018-09-21}}</ref> Die erwähnten Proteine sind wesentlich am polaren Auxin Transport der Zellen beteiligt und spielen damit auch eine große Rolle im lichtinduzierten Auxin-abhängigen Streckungswachstum.<ref>{{Literatur |Autor=Jürgen Kleine-Vehn, Pankaj Dhonukshe, Ranjan Swarup, Malcolm Bennett, Jiří Friml |Titel=Subcellular Trafficking of the Arabidopsis Auxin Influx Carrier AUX1 Uses a Novel Pathway Distinct from PIN1 |Hrsg= |Sammelwerk=The Plant Cell |Band=18 |Nummer=11 |Auflage= |Verlag= |Ort= |Datum=2006-11-01 |ISBN= |ISSN=1040-4651 |DOI=10.1105/tpc.106.042770 |PMC=PMC1693951 |PMID=17114355 |Seiten=3171–3181 |Online=http://www.plantcell.org/content/18/11/3171 |Abruf=2018-09-21}}</ref> Bei Versuchen wurden zudem erstmals Thiolgruppen-Addukte der Sesquiterpenlactone in den Pflanzengeweben nachgewiesen und daraufhin ein bisher ungeklärter Inaktivierungsmechanismus für die mutmaßlichen Auxininhibitoren postuliert. Die Bindung von Thiolgruppen könnte demnach auch Teil der Negativ-Regulation der Verbindungen sein. Sesquiterpenlactone werden in sehr geringen Konzentrationen auch in die [[Rhizosphäre]] exsudiert, was die Annahme des abwärts gerichteten Transports stützt. Zudem konnte nachgewiesen werden, dass geringste Konzentrationen von Dehydrocostuslacton im Boden in der Lage sind, die Keimung der parasitischen [[Sommerwurzen|Sommerwurz]] Samen (''[[Sommerwurzen|Orobanche cumana]]'') zu stimulieren.<ref>{{Literatur |Autor=Daniel M. Joel, Swapan K. Chaudhuri, Dina Plakhine, Hammam Ziadna, John C. Steffens |Titel=Dehydrocostus lactone is exuded from sunflower roots and stimulates germination of the root parasite Orobanche cumana |Sammelwerk=Phytochemistry |Band=72 |Nummer=7 |Datum=2011-05 |ISSN=0031-9422 |DOI=10.1016/j.phytochem.2011.01.037 |Seiten=624–634 |Online=https://linkinghub.elsevier.com/retrieve/pii/S0031942211000665 |Abruf=2018-09-21}}</ref> Wenige Jahre später wurden auch Tomentosin, Costunolid und 8-Epixanthatin in [[Wurzelexsudaten]] als [[Keimungsstimulatoren]] für die Samen von ''Orobanche cumana'' identifiziert.<ref>{{Literatur |Autor=Frank M. Raupp, Otmar Spring |Titel=New Sesquiterpene Lactones from Sunflower Root Exudate as Germination Stimulants for Orobanche cumana |Sammelwerk=Journal of Agricultural and Food Chemistry |Band=61 |Nummer=44 |Datum=2013-10-24 |ISSN=0021-8561 |DOI=10.1021/jf402392e |Seiten=10481–10487 |Online=https://pubs.acs.org/doi/10.1021/jf402392e |Abruf=2018-09-21}}</ref> |
|||
== Medizinischer Nutzen == |
|||
Einige Vertreter der Sesquiterpenlactone sind von pharmakologischem Interesse, da ihnen antitumorale, migräne- und [[Entzündungshemmung|entzündungshemmende]] sowie antimikrobielle Eigenschaften zugeschrieben werden und sie toxisch für einige wichtige [[Humanpathogen|humanpathogene]] Erreger wie z.B. [[Trypanosomen]] sind.<ref>{{Literatur |Autor=S. P. Hehner, T. G. Hofmann, W. Dröge, M. L. Schmitz |Titel=The antiinflammatory sesquiterpene lactone parthenolide inhibits NF-kappa B by targeting the I kappa B kinase complex |Sammelwerk=Journal of Immunology (Baltimore, Md.: 1950) |Band=163 |Nummer=10 |Datum=1999-11-15 |ISSN=0022-1767 |PMID=10553091 |Seiten=5617–5623 |Online=https://www.ncbi.nlm.nih.gov/pubmed/10553091 |Abruf=2018-09-21}}</ref><ref>{{Literatur |Autor=Anna K. Picman |Titel=Biological activities of sesquiterpene lactones |Sammelwerk=Biochemical Systematics and Ecology |Band=14 |Nummer=3 |Datum=1986-05 |ISSN=0305-1978 |DOI=10.1016/0305-1978(86)90101-8 |Seiten=255–281 |Online=https://linkinghub.elsevier.com/retrieve/pii/0305197886901018 |Abruf=2018-09-21}}</ref><ref>{{Literatur |Autor=Thomas J. Schmidt, Fernando B. Da Costa, Norberto P. Lopes, Marcel Kaiser, Reto Brun |Titel=In Silico Prediction and Experimental Evaluation of Furanoheliangolide Sesquiterpene Lactones as Potent Agents against Trypanosoma brucei rhodesiense |Sammelwerk=Antimicrobial Agents and Chemotherapy |Band=58 |Nummer=1 |Datum=2014-01-01 |ISSN=0066-4804 |DOI=10.1128/AAC.01263-13 |PMC=PMC3910805 |PMID=24165182 |Seiten=325–332 |Online=https://aac.asm.org/content/58/1/325 |Abruf=2018-09-21}}</ref> Viele der Wirkungen dieser Substanzen macht man sich in der traditionellen Medizin bereits seit Jahrhunderten zu Nutze. So ist etwa die entzündungshemmende Wirkung der ''[[Arnica montana]]'', die in Europa seit dem Mittelalter als Heilpflanze bekannt ist, auf Sesquiterpenlactone zurückzuführen. Ebenso die Wirkungen der ''[[Mikania]] micrantha'', die in Mittel- und Südamerika beheimatet ist, und der ''[[Saussurea]] lappa'', der in Asien vorkommt. Der entzündungshemmende Effekt dieser Sesquiterpenlactone ist auf eine Hemmung von [[Transkriptionsfaktor]]en wie [[NF-κB]] und [[AP-1]] zurückzuführen.<ref name="Wagner">Steffen Wagner: ''Sesquiterpenlactone: Neuronale Netze als QSAR-Modell sowie pharmakokinetische Untersuchungen am Beispiel von Arnica montana''. Dissertation, 2006. [http://www.freidok.uni-freiburg.de/volltexte/2560/ PDF; 6,03 MB].</ref> |
|||
| ⚫ | |||
== Siehe auch == |
== Siehe auch == |
||
* [[Artemisinin]] |
* [[Artemisinin]] |
||
*[[Tomentosin]] |
|||
*[[8-Epixanthatin]] |
|||
*[[Dehydrocostuslacton]] |
|||
*[[Costunolid]] |
|||
== Einzelnachweise == |
== Einzelnachweise == |
||
Version vom 21. September 2018, 19:09 Uhr
Sesquiterpenlactone sind natürlich vorkommende Terpenderivate, genauer gesagt Sesquiterpenderivate, die eine Lacton-Funktion aufweisen, an der sie häufig eine exocyclische Methylengruppe besitzen.[1] Es sind fast 5000 Vertreter dieser Stoffgruppe bekannt die sich als Sekundärmetaboliten in vielen Pflanzen, vor allem in Vertretern der Familie der Korbblütler (Asteraceae), finden lassen. Sie können unter anderem als taxonomisches Merkmal für Asteraceae verwendet werden.[2] Sesquiterpenlactone spielen eine wichtige Rolle in der Abwehr von Fraßfeinden der Pflanzen, sie wirken hormonartig und sind als bioaktive Substanzen von medizinischem Interesse.
Aufbau
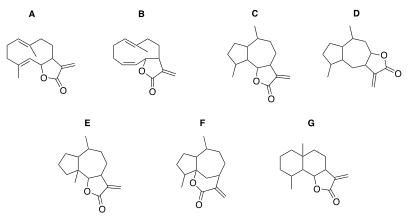
A: Germacranolide, B: Heliangolide, C+D: Guaianolide,
E: Pseudoguaianolide, F: Hypocretenolide, G: Eudesmanolide
Der grundlegende Aufbau von Terpenen besteht aus Isopren-Einheiten. Das sind C5-Körper (5 Kohlenstoff Atome) deren Anzahl und Anordnung je nach Terpentyp variiert.[3] Sesquiterpene bestehen aus drei Isopren-Einheiten und besitzen demnach ein C15-Gundgerüst. Man nimmt an, dass der Biosyntheseweg über den cytosolischen Mevalonatweg verläuft und Farnesylpyrophosphat eine Sesquiterpen-Vorstufe darstellt.[4] Sesquiterpenlactone unterliegen einer Klassifizierung aufgrund der Anordnung ihres Kohlenstoffgrundgerüstes. So gibt es z.B. die Klasse der Xanthanolide, zu der unter anderem Tomentosin und 8-Epixanthatin gehören, die Klasse der Guaianolide, vertreten z.B. durch Dehydrocostuslacton, und die Klasse der Germacranolide mit Costunolid als Exempel.[5]
Funktionen
Die exocyclische Methylengruppe am γ-Lactonring der Sesquiterpenlactone führt durch ihre hohe nukleophile Reaktivität zu einer starken biologischen Aktivität der Verbindungen. Aufgrund dessen kommt es unter anderem zu Reaktionen mit Thiolgruppen, so z.B. der Thiolgruppe der Aminosäure Cystein, was einen Einfluss der Verbindungen auf Proteine ermöglicht.[6] Das Funktions- und Wirkungsspektrum der Sesquiterpenlactone ist sehr breit. Sie besitzen z.B. antimykotische, antibakterielle, zytotoxische, antitumorale, antiinflammatorische und allelopathische Eigenschaften. Auch für Säugetiere wie den Menschen können diese Substanzen toxisch sein, da sie zu Kontaktdermatitis führen können.[7] Für Pflanzen fungieren sie vor allem als Abwehrstoffe gegen Herbivore und Mikroorganismen. Diese Funktion wird einerseits durch ihren bitteren Geschmack und andererseits durch die Zytotoxizität, z.B. durch Eingriffe in den Stoffwechsel der Pathogene, erfüllt. Zur Abwehrzwecken werden sie in spezialisierten Zellen, den köpfchentragenden Drüsenhaaren, auf den Oberflächen der Pflanzen gebildet und in Kutikularblasen sekretiert.[8]
Sesquiterpenlactone als Pflanzenhormone
Neben der Verteidigung der Pflanzen gegen Pathogene und Herbivore haben Sesquiterpenlactone offensichtlich auch hormonelle Wirkungen. Die vier Sesquiterpenlactone Tomentosin, 8-Epixanthatin, Dehydrocostuslacton und Costunolid wurden innerhalb der Pflanzengewebe nachgewiesen. Sie kommen nicht in den Trichomen auf der Pflanzenoberfläche vor und sind um ein vielfaches geringer konzentriert als die in den Trichomen lokalisierten Verbindungen.[9] Innerhalb der Pflanzengewebe wird eine physiologische Funktion der Sesquiterpenlactone als Inhibierung des Auxin-abhängigen Streckungswachstums angenommen.[10][11] Gestützt wird diese These durch Versuche, bei denen gezeigt wurde, dass während einer einseitigen Belichtung von Sonnenblumen Hypokotylen keine differenzierte Verteilung von Auxin stattfindet.[12] Daraus wurde geschlossen, dass Auxininhibitoren auf der belichteten Seite für die Krümmungsreaktion der Pflanzen verantwortlich sein müssten.[13][14] Zudem wurde eine abwärts gerichtete Diffusionsrichtung der Verbindungen nachgewiesen.[15] Daher kann nicht ausgeschlossen werden, dass Sesquiterpenlactone, aufgrund ihrer Eigenschaft an Thiolgruppen binden zu können, mit Proteinen der AUXIN RESISTANT1- und/oder der PIN-Familie interagieren können, und so den polaren Auxin-Transport beeinflussen könnten, der treibende Kraft hinter Phototropismus und Gravitropismus ist. Die Hemmung des abwärts gerichteten Auxintransports wurde experimentell durch Applikation von Dehydrocostuslacton an Hypokotylen von Raphanus gezeigt.[16] Die erwähnten Proteine sind wesentlich am polaren Auxin Transport der Zellen beteiligt und spielen damit auch eine große Rolle im lichtinduzierten Auxin-abhängigen Streckungswachstum.[17] Bei Versuchen wurden zudem erstmals Thiolgruppen-Addukte der Sesquiterpenlactone in den Pflanzengeweben nachgewiesen und daraufhin ein bisher ungeklärter Inaktivierungsmechanismus für die mutmaßlichen Auxininhibitoren postuliert. Die Bindung von Thiolgruppen könnte demnach auch Teil der Negativ-Regulation der Verbindungen sein. Sesquiterpenlactone werden in sehr geringen Konzentrationen auch in die Rhizosphäre exsudiert, was die Annahme des abwärts gerichteten Transports stützt. Zudem konnte nachgewiesen werden, dass geringste Konzentrationen von Dehydrocostuslacton im Boden in der Lage sind, die Keimung der parasitischen Sommerwurz Samen (Orobanche cumana) zu stimulieren.[18] Wenige Jahre später wurden auch Tomentosin, Costunolid und 8-Epixanthatin in Wurzelexsudaten als Keimungsstimulatoren für die Samen von Orobanche cumana identifiziert.[19]
Medizinischer Nutzen
Einige Vertreter der Sesquiterpenlactone sind von pharmakologischem Interesse, da ihnen antitumorale, migräne- und entzündungshemmende sowie antimikrobielle Eigenschaften zugeschrieben werden und sie toxisch für einige wichtige humanpathogene Erreger wie z.B. Trypanosomen sind.[20][21][22] Viele der Wirkungen dieser Substanzen macht man sich in der traditionellen Medizin bereits seit Jahrhunderten zu Nutze. So ist etwa die entzündungshemmende Wirkung der Arnica montana, die in Europa seit dem Mittelalter als Heilpflanze bekannt ist, auf Sesquiterpenlactone zurückzuführen. Ebenso die Wirkungen der Mikania micrantha, die in Mittel- und Südamerika beheimatet ist, und der Saussurea lappa, der in Asien vorkommt. Der entzündungshemmende Effekt dieser Sesquiterpenlactone ist auf eine Hemmung von Transkriptionsfaktoren wie NF-κB und AP-1 zurückzuführen.[23]

Siehe auch
Einzelnachweise
- ↑ Nikolaus H. Fischer: Sesquiterpene Lactones: Biogenesis and Biomimetic Transformations. In: Biochemistry of the Mevalonic Acid Pathway to Terpenoids. Springer US, Boston, MA 1990, ISBN 978-1-4684-8791-6, S. 161–201, doi:10.1007/978-1-4684-8789-3_4 (springer.com [abgerufen am 21. September 2018]).
- ↑ Thomas J. Schmidt: Toxic Activities of Sesquiterpene Lactones – Structural and Biochemical Aspects. In: Current Organic Chemistry 3, 1999, S. 577–605; Abstract.
- ↑ L. Ruzicka: The isoprene rule and the biogenesis of terpenic compounds. In: Experientia. Band 9, Nr. 10, Oktober 1953, ISSN 0014-4754, S. 357–367, doi:10.1007/bf02167631 (springer.com [abgerufen am 21. September 2018]).
- ↑ Helga D. Fischer, N. H. Fischer, R. W. Franck, E. J. Olivier: Fortschritte der Chemie organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products. In: Fortschritte der Chemie organischer Naturstoffe / Progress in the Chemistry of Organic Natural Products. 1979, ISSN 0071-7886, doi:10.1007/978-3-7091-8548-3 (springer.com [abgerufen am 21. September 2018]).
- ↑ Frederick C. Seaman: Sesquiterpene lactones as taxonomic characters in the asteraceae. In: The Botanical Review. Band 48, Nr. 2, April 1982, ISSN 0006-8101, S. 121–594, doi:10.1007/bf02919190 (springer.com [abgerufen am 21. September 2018]).
- ↑ Otmar Spring, Achim Hager: Inhibition of elongation growth by two sesquiterpene lactones isolated from Helianthus annuus L. In: Planta. Band 156, Nr. 5, Dezember 1982, ISSN 0032-0935, S. 433–440, doi:10.1007/bf00393314 (springer.com [abgerufen am 21. September 2018]).
- ↑ Anna K. Picman: Biological activities of sesquiterpene lactones. In: Biochemical Systematics and Ecology. Band 14, Nr. 3, Mai 1986, ISSN 0305-1978, S. 255–281, doi:10.1016/0305-1978(86)90101-8 (elsevier.com [abgerufen am 21. September 2018]).
- ↑ Otmar Spring, Uta Bienert, Volker Klemt: Sesquiterpene Lactones in Glandular Trichomes of Sunflower Leaves. In: Journal of Plant Physiology. Band 130, Nr. 4-5, Oktober 1987, ISSN 0176-1617, S. 433–439, doi:10.1016/s0176-1617(87)80208-0 (elsevier.com [abgerufen am 21. September 2018]).
- ↑ Frank M. Raupp, Otmar Spring: New Sesquiterpene Lactones from Sunflower Root Exudate as Germination Stimulants for Orobanche cumana. In: Journal of Agricultural and Food Chemistry. Band 61, Nr. 44, 24. Oktober 2013, ISSN 0021-8561, S. 10481–10487, doi:10.1021/jf402392e (acs.org [abgerufen am 21. September 2018]).
- ↑ Otmar Spring, Achim Hager: Inhibition of elongation growth by two sesquiterpene lactones isolated from Helianthus annuus L. In: Planta. Band 156, Nr. 5, Dezember 1982, ISSN 0032-0935, S. 433–440, doi:10.1007/bf00393314 (springer.com [abgerufen am 21. September 2018]).
- ↑ Kaori Yokotani-Tomita, Jun Kato, Seiji Kosemura, Shosuke Yamamura, Midori Kushima: Light-induced auxin-inhibiting substance from sunflower seedlings. In: Phytochemistry. Band 46, Nr. 3, Oktober 1997, ISSN 0031-9422, S. 503–506, doi:10.1016/s0031-9422(97)00307-5 (elsevier.com [abgerufen am 21. September 2018]).
- ↑ J. BRUINSMA, C.M. KARSSEN, M. BENSCHOP, J.B. VAN DORT: Hormonal Regulation of Phototropism in the Light-grown Sunflower Seedling,Helianthus annuusL.: Immobility of Endogenous Indoleacetic Acid and Inhibition of Hypocotyl Growth by Illuminated Cotyledons. In: Journal of Experimental Botany. Band 26, Nr. 3, 1975, ISSN 0022-0957, S. 411–418, doi:10.1093/jxb/26.3.411 (oup.com [abgerufen am 21. September 2018]).
- ↑ Martin Feyerabend, Elmar W. Weiler: Immunological estimation of growth regulator distribution in phototropically reacting sunflower seedlings. In: Physiologia Plantarum. Band 74, Nr. 1, September 1988, ISSN 0031-9317, S. 185–193, doi:10.1111/j.1399-3054.1988.tb04962.x (wiley.com [abgerufen am 21. September 2018]).
- ↑ Johan Bruinsma, Koji Hasegawa: A new theory of phototropism - its regulation by a light-induced gradient of auxin-inhibiting substances. In: Physiologia Plantarum. Band 79, Nr. 4, August 1990, ISSN 0031-9317, S. 700–704, doi:10.1111/j.1399-3054.1990.tb00047.x (wiley.com [abgerufen am 21. September 2018]).
- ↑ SHIBAOKA, HIROH: STUDIES ON THE MECHANISM OF GROWTH INHIBITING EFFECT OF LIGHT. In: Plant and Cell Physiology. Band 2, Nr. 2, Mai 1961, ISSN 1471-9053, doi:10.1093/oxfordjournals.pcp.a077675 (oup.com [abgerufen am 21. September 2018]).
- ↑ Junichi Ueda, Yuta Toda, Kiyotaka Kato, Yuichi Kuroda, Tsukasa Arai: Identification of dehydrocostus lactone and 4-hydroxy-β-thujone as auxin polar transport inhibitors. In: Acta Physiologiae Plantarum. Band 35, Nr. 7, 29. März 2013, ISSN 0137-5881, S. 2251–2258, doi:10.1007/s11738-013-1261-6 (springer.com [abgerufen am 21. September 2018]).
- ↑ Jürgen Kleine-Vehn, Pankaj Dhonukshe, Ranjan Swarup, Malcolm Bennett, Jiří Friml: Subcellular Trafficking of the Arabidopsis Auxin Influx Carrier AUX1 Uses a Novel Pathway Distinct from PIN1. In: The Plant Cell. Band 18, Nr. 11, 1. November 2006, ISSN 1040-4651, S. 3171–3181, doi:10.1105/tpc.106.042770, PMID 17114355, PMC 1693951 (freier Volltext) – (plantcell.org [abgerufen am 21. September 2018]).
- ↑ Daniel M. Joel, Swapan K. Chaudhuri, Dina Plakhine, Hammam Ziadna, John C. Steffens: Dehydrocostus lactone is exuded from sunflower roots and stimulates germination of the root parasite Orobanche cumana. In: Phytochemistry. Band 72, Nr. 7, Mai 2011, ISSN 0031-9422, S. 624–634, doi:10.1016/j.phytochem.2011.01.037 (elsevier.com [abgerufen am 21. September 2018]).
- ↑ Frank M. Raupp, Otmar Spring: New Sesquiterpene Lactones from Sunflower Root Exudate as Germination Stimulants for Orobanche cumana. In: Journal of Agricultural and Food Chemistry. Band 61, Nr. 44, 24. Oktober 2013, ISSN 0021-8561, S. 10481–10487, doi:10.1021/jf402392e (acs.org [abgerufen am 21. September 2018]).
- ↑ S. P. Hehner, T. G. Hofmann, W. Dröge, M. L. Schmitz: The antiinflammatory sesquiterpene lactone parthenolide inhibits NF-kappa B by targeting the I kappa B kinase complex. In: Journal of Immunology (Baltimore, Md.: 1950). Band 163, Nr. 10, 15. November 1999, ISSN 0022-1767, S. 5617–5623, PMID 10553091 (nih.gov [abgerufen am 21. September 2018]).
- ↑ Anna K. Picman: Biological activities of sesquiterpene lactones. In: Biochemical Systematics and Ecology. Band 14, Nr. 3, Mai 1986, ISSN 0305-1978, S. 255–281, doi:10.1016/0305-1978(86)90101-8 (elsevier.com [abgerufen am 21. September 2018]).
- ↑ Thomas J. Schmidt, Fernando B. Da Costa, Norberto P. Lopes, Marcel Kaiser, Reto Brun: In Silico Prediction and Experimental Evaluation of Furanoheliangolide Sesquiterpene Lactones as Potent Agents against Trypanosoma brucei rhodesiense. In: Antimicrobial Agents and Chemotherapy. Band 58, Nr. 1, 1. Januar 2014, ISSN 0066-4804, S. 325–332, doi:10.1128/AAC.01263-13, PMID 24165182, PMC 3910805 (freier Volltext) – (asm.org [abgerufen am 21. September 2018]).
- ↑ Steffen Wagner: Sesquiterpenlactone: Neuronale Netze als QSAR-Modell sowie pharmakokinetische Untersuchungen am Beispiel von Arnica montana. Dissertation, 2006. PDF; 6,03 MB.