„Schichtstruktur“ – Versionsunterschied
| [ungesichtete Version] | [ungesichtete Version] |
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 3: | Zeile 3: | ||
Von einer '''Schichtstruktur''' kann gesprochen werden, wenn die Wechselwirkungen zwischen den Bausteinen innerhalb einer Ebene (Schicht) größer sind, als die Wechselwirkungen zwischen den Ebenen. Dies ist bei manchen [[Kristallstruktur|Kristallstrukturen]] der Fall. Innerhalb der Schichten sind [[Polarität (Chemie)|polare]], [[Kovalente Bindung|kovalente Bindungen]] vorhanden, was in eine zweidimensionale Verknüpfung resultiert. Zwischen den Schichten herrschen relativ schwache [[van-der-Waals-Kräfte]]. Dies zeigt sich in unterschiedlichen [[Atomabstand|Atomabständen]] und führt zu einer guten Spaltbarkeit parallel zu den Schichten. Bekannte Beispiele für Verbindungen mit Schichtstruktur sind [[Glimmergruppe|Glimmer]], [[Graphit]] und [[Montmorillonit]].<ref>{{Internetquelle |url=https://roempp.thieme.de/roempp4.0/do/data/RD-19-00842 |titel=Schichtstrukturen - RÖMPP, Thieme |zugriff=2018-11-15}}</ref><ref name=":0">{{Literatur |Autor=Erwin Riedel, Christoph Janiak |Titel=Anorganische Chemie |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage=8. |Verlag=De Gruyter |Ort=Berlin |Datum=2011 |ISBN=9783110225679 |OCLC= |Seiten=138-139 |Online= |Abruf=}}</ref> |
Von einer '''Schichtstruktur''' kann gesprochen werden, wenn die Wechselwirkungen zwischen den Bausteinen innerhalb einer Ebene (Schicht) größer sind, als die Wechselwirkungen zwischen den Ebenen. Dies ist bei manchen [[Kristallstruktur|Kristallstrukturen]] der Fall. Innerhalb der Schichten sind [[Polarität (Chemie)|polare]], [[Kovalente Bindung|kovalente Bindungen]] vorhanden, was in eine zweidimensionale Verknüpfung resultiert. Zwischen den Schichten herrschen relativ schwache [[van-der-Waals-Kräfte]]. Dies zeigt sich in unterschiedlichen [[Atomabstand|Atomabständen]] und führt zu einer guten Spaltbarkeit parallel zu den Schichten. Bekannte Beispiele für Verbindungen mit Schichtstruktur sind [[Glimmergruppe|Glimmer]], [[Graphit]] und [[Montmorillonit]].<ref>{{Internetquelle |url=https://roempp.thieme.de/roempp4.0/do/data/RD-19-00842 |titel=Schichtstrukturen - RÖMPP, Thieme |zugriff=2018-11-15}}</ref><ref name=":0">{{Literatur |Autor=Erwin Riedel, Christoph Janiak |Titel=Anorganische Chemie |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage=8. |Verlag=De Gruyter |Ort=Berlin |Datum=2011 |ISBN=9783110225679 |OCLC= |Seiten=138-139 |Online= |Abruf=}}</ref> |
||
== Verbindungen mit Schichtstruktur == |
== Beispiele für Verbindungen mit Schichtstruktur == |
||
[[Datei:Intercalactionrp.png|mini|Interkalation von Metall-Atomen zwischen Schichtebenen von Graphit.|alternativtext=]] |
[[Datei:Intercalactionrp.png|mini|Interkalation von Metall-Atomen zwischen Schichtebenen von Graphit.|alternativtext=]] |
||
=== Graphit === |
=== Graphit === |
||
Graphit besteht aus Schichten von [[Kohlenstoff]]-Atomen und kann als das einfachste Beispiel für eine Schichtstruktur genannt werden. Der Abstand zwischen den Kohlenstoff-Atomen innerhalb einer Schicht beträgt 142 [[Pikometer|pm]], der Abstand zwischen den Schichten beträgt hingegen 335 pm. Die Schichten werden durch schwache van-der-Waals-Kräfte zusammengehalten. Mit der Schichtstruktur lässt sich die [[Leitfähigkeit]] von Graphit erklären, die parallel zu den Schichtebenen etwa 5000-mal größer ist als senkrecht zu den Ebenen |
Graphit besteht aus Schichten von [[Kohlenstoff]]-Atomen und kann als das einfachste Beispiel für eine Schichtstruktur genannt werden. Der Abstand zwischen den Kohlenstoff-Atomen innerhalb einer Schicht beträgt 142 [[Pikometer|pm]], der Abstand zwischen den Schichten beträgt hingegen 335 pm. Die Schichten werden durch schwache van-der-Waals-Kräfte zusammengehalten. Mit der Schichtstruktur lässt sich die [[Leitfähigkeit]] von Graphit erklären, die parallel zu den Schichtebenen etwa 5000-mal größer ist als senkrecht zu den Ebenen.<ref name=":1">{{Literatur |Autor=James E. Huheey, Ellen A. Keiter, Richard L. Keiter |Titel=Anorganische Chemie : Prinzipien von Struktur und Reaktivität |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage=3. |Verlag=De Gruyter |Ort=Berlin |Datum=2003 |ISBN=3-11-017903-2 |Seiten=879–880}}</ref><ref name=":2">{{Literatur |Autor=Michael Binnewies, Maik Finze, Manfred Jäckel, Peer Schmidt, Helge Willner |Titel=Allgemeine und Anorganische Chemie |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage=3. |Verlag=Springer Spektrum |Ort=Berlin |Datum=2016 |ISBN= |DOI=10.1007/978-3-662-45067-3 |Seiten=485–486 |Online=https://link.springer.com/book/10.1007%2F978-3-662-45067-3 |Abruf=}}</ref> |
||
=== Übergangsmetallhalogenide === |
=== Übergangsmetallhalogenide === |
||
| Zeile 13: | Zeile 13: | ||
==== Cadmiumiodid-Struktur (CdI<sub>2</sub>) ==== |
==== Cadmiumiodid-Struktur (CdI<sub>2</sub>) ==== |
||
[[Cadmiumiodid]] kristallisiert in einer Schichtstruktur im [[Hexagonales Kristallsystem|hexagonalen Kristallsystem]] und ist namensgebend für den CdI<sub>2</sub>-[[Strukturtyp]]. Die Struktur ist aus übereinander gestapeltem Schichtsystemen - ICdI - ICdI - aufgebaut. Innerhalb dieser Schichten liegen kovalente Bindungen mit Ionenbildungsanteilen vor, wobei die [[Cadmium]]-Atome oktaedrisch koordiniert sind. Die Iodidionen bilden eine hexagonal-dichteste Kugelpackung, in der nur jede zweite Oktaederlückenschicht mit Cadmiumionen besetzt ist. Die Anionenschichten treten in der Schichtenfolge ABAB auf.<ref name=":0" /><ref>{{Literatur |Autor=Michael Binnewies, Maik Finze, Manfred Jäckel, Peer Schmidt, Helge Willner |Titel=Allgemeine und Anorganische Chemie |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage=3. |Verlag=Springer Spektrum |Ort=Berlin |Datum=2016 |ISBN= |DOI=10.1007/978-3-662-45067-3 |Seiten=90–91 |Online=https://link.springer.com/book/10.1007%2F978-3-662-45067-3 |Abruf=}}</ref> |
[[Cadmiumiodid]] kristallisiert in einer Schichtstruktur im [[Hexagonales Kristallsystem|hexagonalen Kristallsystem]] und ist namensgebend für den CdI<sub>2</sub>-[[Strukturtyp]]. Die Struktur ist aus übereinander gestapeltem Schichtsystemen - ICdI - ICdI - aufgebaut. Innerhalb dieser Schichten liegen kovalente Bindungen mit Ionenbildungsanteilen vor, wobei die [[Cadmium]]-Atome oktaedrisch koordiniert sind. Die Iodidionen bilden eine hexagonal-dichteste Kugelpackung, in der nur jede zweite [[Oktaederlücke|Oktaederlückenschicht]] mit Cadmiumionen besetzt ist. Die Anionenschichten treten in der Schichtenfolge ABAB auf.<ref name=":0" /><ref>{{Literatur |Autor=Michael Binnewies, Maik Finze, Manfred Jäckel, Peer Schmidt, Helge Willner |Titel=Allgemeine und Anorganische Chemie |Hrsg= |Sammelwerk= |Band= |Nummer= |Auflage=3. |Verlag=Springer Spektrum |Ort=Berlin |Datum=2016 |ISBN= |DOI=10.1007/978-3-662-45067-3 |Seiten=90–91 |Online=https://link.springer.com/book/10.1007%2F978-3-662-45067-3 |Abruf=}}</ref> |
||
Beispiele für Verbindungen, die der Cadmiumiodid-Struktur kristallisieren, sind [[Titan(II)-chlorid]], [[Titan(II)-iodid]] und [[Magnesiumbromid]]. |
Beispiele für Verbindungen, die der Cadmiumiodid-Struktur kristallisieren, sind [[Titan(II)-chlorid]], [[Titan(II)-iodid]] und [[Magnesiumbromid]]. |
||
| Zeile 21: | Zeile 21: | ||
Vertreter der Cadmiumchlorid-Struktur sind beispielsweise [[Magnesiumchlorid]], [[Nickel(II)-bromid]] und [[Zinkiodid]]. |
Vertreter der Cadmiumchlorid-Struktur sind beispielsweise [[Magnesiumchlorid]], [[Nickel(II)-bromid]] und [[Zinkiodid]]. |
||
=== Metalldisulfide === |
|||
Viele Metall[[disulfide]] kristallisieren in der '''CdI<sub>2</sub>-Struktur''' und sind aus einer Sulfidschicht, einer Metallschicht und wieder einer Sulfidschicht aufgebaut (S–M–S). Die Metallatome besetzen jede zweite Oktaederlückenschicht der hexagonal dichtesten Anionenpackung. Dies trift beispielsweise auf die Verbindungen [[Titan(IV)-sulfid]], [[Zirkonium(IV)-sulfid]] und [[Platin(IV)-sulfid]] zu. |
|||
Einige Metalldisulfide kristallisieren auch nach der '''[[Molybdän(IV)-sulfid|MoS<sub>2</sub>]]-Struktur''', wo die Metallatome trigonal-prismatische Lücken zwischen paarweise gestapelten Anionenschichten (AA, BB oder CC) besetzen. Beispiele hierfür sind [[Niob(IV)-sulfid]] und [[Wolfram(IV)-sulfid]]. |
|||
=== Iod === |
=== Iod === |
||
| Zeile 38: | Zeile 43: | ||
Datei:Carletonite-20258.jpg|[[Carletonit]] |
Datei:Carletonite-20258.jpg|[[Carletonit]] |
||
</gallery> |
</gallery> |
||
== Anwendungen == |
|||
Feststoffe mit Schichtstruktur wie Graphit oder Molybdän(IV)-sulfid werden häufig als [[Schmierstoff|Schmiermittel]] verwendet. Dabei können sich die Kohlenstoff- oder Sulfidschichten blätterartig parallel zu den Schichten verschieben.<ref>{{Literatur |Autor=Marc-Denis Weitze, Christina Berger |Titel=Werkstoffe für Mobilität |Hrsg= |Sammelwerk=Technik im Fokus |Band= |Nummer= |Auflage= |Verlag=Springer |Ort=Berlin, Heidelberg |Datum=2013 |ISBN=9783642295409 |DOI=10.1007/978-3-642-29541-6_5 |Seiten=119–135 |Online=https://link.springer.com/chapter/10.1007%2F978-3-642-29541-6_5 |Abruf=}}</ref> |
|||
Ein weiterer Anwendungsschwerpunkt liegt in der Möglichkeit, zwischen den Schichten Substanzen einzulagern ([[Interkalation (Chemie)|Interkalation]]). Solche Interkalationsverbindungen finden eine wichtige praktische Anwendung in vielen Bereichen, z. B. der [[Lithium-Ionen-Akkumulator|Lithium-Ionen-Batterie]], wo Lithium-Atome zwischen die Graphitschichten interkaliert werden. Als [[Leiter (Physik)|elektrische Leiter]] werden zudem [[Kalium]]- und Polybromid-Graphit-Einlagerungsverbindungen genutzt. Neben [[Anorganische Chemie|anorganischen]] Stoffen lassen sich auch eine Reihe an [[Organische Chemie|organischen]] Verbindungen in Substanzen mit Schichtstrukturen einlagern. Ein Anwendungsbeispiel hierfür ist die [[Adsorption|Adsorbtion]] von [[Ferrocen]] an einzelne molekulare Molybdän(IV)-sulfidschichten. Das Adsorbat kann anschließend als elektrisch leitender Film auf eine Glasunterlage gezogen werden.<ref name=":1" /><ref name=":2" /> |
|||
== Einzelnachweise == |
== Einzelnachweise == |
||
Version vom 17. November 2018, 13:02 Uhr
Diese Baustelle befindet sich fälschlicherweise im Artikelnamensraum. Bitte verschiebe die Seite oder entferne den Baustein {{Baustelle}}.
|

Von einer Schichtstruktur kann gesprochen werden, wenn die Wechselwirkungen zwischen den Bausteinen innerhalb einer Ebene (Schicht) größer sind, als die Wechselwirkungen zwischen den Ebenen. Dies ist bei manchen Kristallstrukturen der Fall. Innerhalb der Schichten sind polare, kovalente Bindungen vorhanden, was in eine zweidimensionale Verknüpfung resultiert. Zwischen den Schichten herrschen relativ schwache van-der-Waals-Kräfte. Dies zeigt sich in unterschiedlichen Atomabständen und führt zu einer guten Spaltbarkeit parallel zu den Schichten. Bekannte Beispiele für Verbindungen mit Schichtstruktur sind Glimmer, Graphit und Montmorillonit.[1][2]
Beispiele für Verbindungen mit Schichtstruktur

Graphit
Graphit besteht aus Schichten von Kohlenstoff-Atomen und kann als das einfachste Beispiel für eine Schichtstruktur genannt werden. Der Abstand zwischen den Kohlenstoff-Atomen innerhalb einer Schicht beträgt 142 pm, der Abstand zwischen den Schichten beträgt hingegen 335 pm. Die Schichten werden durch schwache van-der-Waals-Kräfte zusammengehalten. Mit der Schichtstruktur lässt sich die Leitfähigkeit von Graphit erklären, die parallel zu den Schichtebenen etwa 5000-mal größer ist als senkrecht zu den Ebenen.[3][4]
Übergangsmetallhalogenide

Cadmiumiodid-Struktur (CdI2)
Cadmiumiodid kristallisiert in einer Schichtstruktur im hexagonalen Kristallsystem und ist namensgebend für den CdI2-Strukturtyp. Die Struktur ist aus übereinander gestapeltem Schichtsystemen - ICdI - ICdI - aufgebaut. Innerhalb dieser Schichten liegen kovalente Bindungen mit Ionenbildungsanteilen vor, wobei die Cadmium-Atome oktaedrisch koordiniert sind. Die Iodidionen bilden eine hexagonal-dichteste Kugelpackung, in der nur jede zweite Oktaederlückenschicht mit Cadmiumionen besetzt ist. Die Anionenschichten treten in der Schichtenfolge ABAB auf.[2][5]
Beispiele für Verbindungen, die der Cadmiumiodid-Struktur kristallisieren, sind Titan(II)-chlorid, Titan(II)-iodid und Magnesiumbromid.
Cadmiumchlorid-Struktur (CdCl2)
Bei der Cadmiumchlorid-Struktur handelt es sich ebenfalls um eine Schichtstruktur. Die Cadmiumionen besetzen Oktaederlücken jeder zweiten Schicht und die Chloratome sind kubisch dichtest gepackt. Während in der Cadmiumiodid-Struktur die Schichten genau übereinander liegen, sind sie in der Cadmiumchlorid-Struktur gegeneinander verschoben (Schichtfolge ABCABC).[2][6]
Vertreter der Cadmiumchlorid-Struktur sind beispielsweise Magnesiumchlorid, Nickel(II)-bromid und Zinkiodid.
Metalldisulfide
Viele Metalldisulfide kristallisieren in der CdI2-Struktur und sind aus einer Sulfidschicht, einer Metallschicht und wieder einer Sulfidschicht aufgebaut (S–M–S). Die Metallatome besetzen jede zweite Oktaederlückenschicht der hexagonal dichtesten Anionenpackung. Dies trift beispielsweise auf die Verbindungen Titan(IV)-sulfid, Zirkonium(IV)-sulfid und Platin(IV)-sulfid zu.
Einige Metalldisulfide kristallisieren auch nach der MoS2-Struktur, wo die Metallatome trigonal-prismatische Lücken zwischen paarweise gestapelten Anionenschichten (AA, BB oder CC) besetzen. Beispiele hierfür sind Niob(IV)-sulfid und Wolfram(IV)-sulfid.
Iod
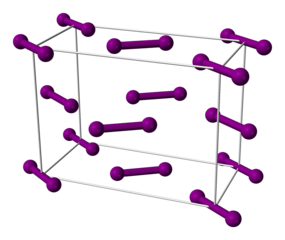
Wie bereits aus der Schuppengestalt des festen Iods erkennbar, bildet Iod im festen Zustand ein Schichtstruktur aus. Die Iod-Mokelüle liegen innerhalb der Schichten alle in einer Ebene. Dabei ist der Abstand zweier Iod-Atome von benachbarten Iod-Molekülen innerhalb einer Schicht um 20 bis 80 pm kleiner als der Abstand zwischen den Schichten. Innerhalb der Schichten kommen sich die Iod-Moleküle viel näher (bis zu 349,6 pm) als der doppelte van-der-Waals-Radius (430 pm), jedoch nicht so nahe wie bei normalen kovalenten Bindungen. Zwischen den Iod-Molekülen liegen daher erhebliche elektronische Wechselwirkungen, welche die Halbleitereigenschaft und den Metallglanz festen Iods bedingen. Festes Brom und Chlor sind entsprechend festem Iod aufgebaut, jedoch mit weniger drastisch verkürztem Abstand zwischen den Halogenmolekülen.[7][8]
-
Festes, kristallines Iod
-
Struktur einer Schicht im festen Iod
-
Dreidimensionale Struktur von festem Iod
Schichtsilikate
→ Hauptartikel: Schichtsilikate
Bei den Schichtsilikaten ist jedes SiO4-Tetraeder in einer Ebene über drei Ecken mit Nachbartetraedern verknüpft. Dadurch bilden sich zweidimensionale Schichten des Anions [Si4O10]4−. Wenn zwischen den Schichten lediglich van-der-Waals-Kräfte auftreten (z. B. bei Talk und Kaolinit), ergeben sich weiche Minerale mit Schichten, die leicht gegeneinander verschiebbar sind. Werden die Schichten durch Kationen zusammengehalten, führt dies zu einer größeren Härte bei gleichzeitiger guter Spaltbarkeit parallel zu den Schichten. Dies ist beispielsweise bei der Struktur der Glimmer der Fall.[9][10]
-
Biotit (Glimmergruppe)
-
Talk
-
Kaolinit
Anwendungen
Feststoffe mit Schichtstruktur wie Graphit oder Molybdän(IV)-sulfid werden häufig als Schmiermittel verwendet. Dabei können sich die Kohlenstoff- oder Sulfidschichten blätterartig parallel zu den Schichten verschieben.[11]
Ein weiterer Anwendungsschwerpunkt liegt in der Möglichkeit, zwischen den Schichten Substanzen einzulagern (Interkalation). Solche Interkalationsverbindungen finden eine wichtige praktische Anwendung in vielen Bereichen, z. B. der Lithium-Ionen-Batterie, wo Lithium-Atome zwischen die Graphitschichten interkaliert werden. Als elektrische Leiter werden zudem Kalium- und Polybromid-Graphit-Einlagerungsverbindungen genutzt. Neben anorganischen Stoffen lassen sich auch eine Reihe an organischen Verbindungen in Substanzen mit Schichtstrukturen einlagern. Ein Anwendungsbeispiel hierfür ist die Adsorbtion von Ferrocen an einzelne molekulare Molybdän(IV)-sulfidschichten. Das Adsorbat kann anschließend als elektrisch leitender Film auf eine Glasunterlage gezogen werden.[3][4]
Einzelnachweise
- ↑ Schichtstrukturen - RÖMPP, Thieme. Abgerufen am 15. November 2018.
- ↑ a b c Erwin Riedel, Christoph Janiak: Anorganische Chemie. 8. Auflage. De Gruyter, Berlin 2011, ISBN 978-3-11-022567-9, S. 138–139.
- ↑ a b James E. Huheey, Ellen A. Keiter, Richard L. Keiter: Anorganische Chemie : Prinzipien von Struktur und Reaktivität. 3. Auflage. De Gruyter, Berlin 2003, ISBN 3-11-017903-2, S. 879–880.
- ↑ a b Michael Binnewies, Maik Finze, Manfred Jäckel, Peer Schmidt, Helge Willner: Allgemeine und Anorganische Chemie. 3. Auflage. Springer Spektrum, Berlin 2016, S. 485–486, doi:10.1007/978-3-662-45067-3 (springer.com).
- ↑ Michael Binnewies, Maik Finze, Manfred Jäckel, Peer Schmidt, Helge Willner: Allgemeine und Anorganische Chemie. 3. Auflage. Springer Spektrum, Berlin 2016, S. 90–91, doi:10.1007/978-3-662-45067-3 (springer.com).
- ↑ James E. Huheey, Ellen A. Keiter, Richard L. Keiter: Anorganische Chemie : Prinzipien von Struktur und Reaktivität. 3. Auflage. De Gruyter, Berlin 2003, ISBN 3-11-017903-2, S. 296–298.
- ↑ James E. Huheey, Ellen A. Keiter, Richard L. Keiter: Anorganische Chemie : Prinzipien von Struktur und Reaktivität. 3. Auflage. De Gruyter, Berlin 2003, ISBN 3-11-017903-2, S. 980–981.
- ↑ A. F. Holleman, Egon Wiberg: Lehrbuch der anorganischen Chemie. 101. Auflage. De Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 447–448.
- ↑ Silicate - RÖMPP, Thieme. Abgerufen am 16. November 2018.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. 8. Auflage. De Gruyter, Berlin 2011, ISBN 978-3-11-022567-9, S. 540.
- ↑ Marc-Denis Weitze, Christina Berger: Werkstoffe für Mobilität. In: Technik im Fokus. Springer, Berlin, Heidelberg 2013, ISBN 978-3-642-29540-9, S. 119–135, doi:10.1007/978-3-642-29541-6_5 (springer.com).