„Pyrazin“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
Rjh (Diskussion | Beiträge) |
Rjh (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 38: | Zeile 38: | ||
Ab diesem Zeitpunkt wurden verschiedene Derivate von Pyrazin hergestellt. 1882 war [[Severin Segelcke Wleügel]] jedoch der erste der vorschlug, dass Pyrazin aus einem sechsgliedrigen Ring analog zu [[Pyridin]] besteht. Im Jahre 1887 schlugen [[Arthur T. Mason]] und [[Ludwig Wolff (Chemiker)|Ludwig Wolff]] getrennt voneinander vor, dass das Wort "Pyrazin" für die oben erwähnte Verbindung verwendet werden kann. Sie stellten klar, dass eine sechsgliedrige Ringverbindung, die aus vier Kohlenstoff- und zwei Stickstoffatomen besteht, als Diazin klassifiziert wird. Während dieser Zeit debattierten die Chemiker über die mögliche Bindungsstruktur des Pyrazins. So war entweder eine Anordnung vom Kekulé-Typ oder vom Dewar-Typ in Diskussion. Der Kekulé-Typ bezieht sich auf die konjugierte Doppelbindung innerhalb des Pyrazinmoleküls, während der Dewar-Typ sich auf die lange Parabindung bezieht, die die beiden Stickstoffatome bindet. Nach der Analyse der Molekularrefraktion verschiedener Pyrazinderivate bestätigte [[Julius Wilhelm Brühl]] schließlich, dass das Pyrazin in Kekulé-Konfiguration existiert.<ref name="DOI10.33736/bjrst.591.2017" /><ref>J. W. Brühl, [[Zeitschrift für physikalische Chemie]], Stöchiometrie und Verwandtschaftslehre, 22, 373 (1897) (Spektrochemisches Verhalten der Iminoäther)</ref> |
Ab diesem Zeitpunkt wurden verschiedene Derivate von Pyrazin hergestellt. 1882 war [[Severin Segelcke Wleügel]] jedoch der erste der vorschlug, dass Pyrazin aus einem sechsgliedrigen Ring analog zu [[Pyridin]] besteht. Im Jahre 1887 schlugen [[Arthur T. Mason]] und [[Ludwig Wolff (Chemiker)|Ludwig Wolff]] getrennt voneinander vor, dass das Wort "Pyrazin" für die oben erwähnte Verbindung verwendet werden kann. Sie stellten klar, dass eine sechsgliedrige Ringverbindung, die aus vier Kohlenstoff- und zwei Stickstoffatomen besteht, als Diazin klassifiziert wird. Während dieser Zeit debattierten die Chemiker über die mögliche Bindungsstruktur des Pyrazins. So war entweder eine Anordnung vom Kekulé-Typ oder vom Dewar-Typ in Diskussion. Der Kekulé-Typ bezieht sich auf die konjugierte Doppelbindung innerhalb des Pyrazinmoleküls, während der Dewar-Typ sich auf die lange Parabindung bezieht, die die beiden Stickstoffatome bindet. Nach der Analyse der Molekularrefraktion verschiedener Pyrazinderivate bestätigte [[Julius Wilhelm Brühl]] schließlich, dass das Pyrazin in Kekulé-Konfiguration existiert.<ref name="DOI10.33736/bjrst.591.2017" /><ref>J. W. Brühl, [[Zeitschrift für physikalische Chemie]], Stöchiometrie und Verwandtschaftslehre, 22, 373 (1897) (Spektrochemisches Verhalten der Iminoäther)</ref> |
||
== Vorkommen == |
|||
Pyrazin kommt in gerösteten Erdnüssen und anderen erhitzten Lebensmitteln vor.<ref name="Hans-Dieter Belitz, Werner Grosch">{{Literatur| Autor=Hans-Dieter Belitz, Werner Grosch | Titel=Lehrbuch der Lebensmittelchemie | Verlag=Springer-Verlag | ISBN=978-3-662-08304-8 | Jahr=2013 | Online={{Google Buch | BuchID=Rs-yBgAAQBAJ | Seite=328 }} | Seiten=328 }}</ref> |
|||
== Gewinnung und Darstellung == |
== Gewinnung und Darstellung == |
||
Version vom 3. Mai 2020, 23:33 Uhr
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
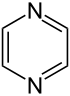
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pyrazin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H4N2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Kristalle oder wachsartige Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 80,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,03 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
115–116 °C[2] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser, Ethanol und Diethylether[1] | ||||||||||||||||||
| Brechungsindex |
1,4953 (61 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
139,8 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Pyrazin (1,4-Diazin) ist eine chemische Verbindung und Namensgeber für die Stoffgruppe der Pyrazine. Es handelt sich um ein Heteroaromat, genauer ein Diazin bzw. Diazabenzol.
Geschichte
Über die Synthese von Pyrazin wurde erstmals 1844 von Auguste Laurent berichtet, wobei 1897 von Snape und Brooke bestätigt wurde, dass es sich um 2,3,5,6-Tetraphenylpyrazin handelt. Laurent nannte diese Verbindung "Amarone".[6]
Ab diesem Zeitpunkt wurden verschiedene Derivate von Pyrazin hergestellt. 1882 war Severin Segelcke Wleügel jedoch der erste der vorschlug, dass Pyrazin aus einem sechsgliedrigen Ring analog zu Pyridin besteht. Im Jahre 1887 schlugen Arthur T. Mason und Ludwig Wolff getrennt voneinander vor, dass das Wort "Pyrazin" für die oben erwähnte Verbindung verwendet werden kann. Sie stellten klar, dass eine sechsgliedrige Ringverbindung, die aus vier Kohlenstoff- und zwei Stickstoffatomen besteht, als Diazin klassifiziert wird. Während dieser Zeit debattierten die Chemiker über die mögliche Bindungsstruktur des Pyrazins. So war entweder eine Anordnung vom Kekulé-Typ oder vom Dewar-Typ in Diskussion. Der Kekulé-Typ bezieht sich auf die konjugierte Doppelbindung innerhalb des Pyrazinmoleküls, während der Dewar-Typ sich auf die lange Parabindung bezieht, die die beiden Stickstoffatome bindet. Nach der Analyse der Molekularrefraktion verschiedener Pyrazinderivate bestätigte Julius Wilhelm Brühl schließlich, dass das Pyrazin in Kekulé-Konfiguration existiert.[6][7]
Vorkommen
Pyrazin kommt in gerösteten Erdnüssen und anderen erhitzten Lebensmitteln vor.[8]
Gewinnung und Darstellung
Pyrazin lässt sich bequem aus der Oxidation von Dihydropyrazin herstellen, das als Kondensationsprodukt von 1,2-Dicarbonyl mit 1,2-Diaminoethan entsteht. Kupfer(II)-oxid und Manganoxid werden üblicherweise als Oxidationsmittel für Dihydropyrazin verwendet.[6]
Ohtsuka et al. berichtete 1979 über eine alternativen Weg zur Synthese durch Zyklisierung von 2,3-Bis(arylidenamino)-3-cyanoarylamiden zur Bildung des Pyrazin-Vorläufers 1,2-Dihydropyrazin.[6][9]
Ebenfalls möglich ist die Darstellung durch Reaktion von Diamin mit Diolen in Gegenwart eines Metallkatalysators oder der Reaktion von Diamin mit Dicarbonylen.[6]
Eigenschaften
Pyrazin ist ein farbloser, leicht entzündlicher Feststoff.[1] Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pmnn (Raumgruppen-Nr. 58, Stellung 3) und zwei Molekülen pro Elementarzelle.[10]
1957 bestimmte Peter Jaffrey Wheatley die Struktur von Pyrazin mit Hilfe der Röntgenstrukturanalyse, wobei die Länge der C-C-, C-N- und C-H-Bindung mit 1,378 Å, 1,334 Å bzw. 1,050 Å bestimmt wurde.[10] 1977 ergaben Untersuchungen mit Gasphasen-Elektronenbeugung, dass die C-C-Bindung von Pyrazin etwas größer als die von Benzol, aber ähnlich wie die von Pyridin ist. Dagegen war die C-N-Bindung von Pyrazin und Pyridin innerhalb der Fehlergrenze gleich. Es ist bemerkenswert, dass die C-H-Bindung von Pyrazin im Vergleich zu Benzol und Pyridin länger ist. Bei diesen Untersuchungen wurden die Werte bestimmt zu: r(C-C) = 1,339 ± 0,002 Å. r(C-N) = 1,403 ± 0,004 Å, r(C-H) = 1,115 ± 0,004 Å. C-C-N = 115,6 ± 0,4°, und C-C-H = 123,9 ± 0,6°.[11]
Einzelnachweise
- ↑ a b c Eintrag zu Pyrazin. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c Datenblatt Pyrazin bei Alfa Aesar (Seite nicht mehr abrufbar).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-448.
- ↑ a b Datenblatt Pyrazine bei Sigma-Aldrich (PDF).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ a b c d e KOK TONG ONG, ZHI-QIANG LIU, MENG GUAN TAY: Review on the Synthesis of Pyrazine and Its Derivatives. In: Borneo Journal of Resource Science and Technology. 7, 2017, S. 60, doi:10.33736/bjrst.591.2017.
- ↑ J. W. Brühl, Zeitschrift für physikalische Chemie, Stöchiometrie und Verwandtschaftslehre, 22, 373 (1897) (Spektrochemisches Verhalten der Iminoäther)
- ↑ Hans-Dieter Belitz, Werner Grosch: Lehrbuch der Lebensmittelchemie. Springer-Verlag, 2013, ISBN 978-3-662-08304-8, S. 328 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Yozo Ohtsuka, Eiko Tohma u. a.: Chemistry of diaminomaleonitrile. 5. Dihydropyrazine synthesis. In: The Journal of Organic Chemistry. 44, 1979, S. 4871, doi:10.1021/jo00394a027.
- ↑ a b P. J. Wheatley: The crystal and molecular structure of pyrazine. In: Acta Crystallographica. 10, S. 182, doi:10.1107/S0365110X57000596.
- ↑ B.J.M. Bormans, G. De With, F.C. Mijlhoff: The molecular structure of pyrazine as determined from gas-phase electron diffraction data. In: Journal of Molecular Structure. 42, 1977, S. 121, doi:10.1016/0022-2860(77)87035-X.

