„Triadimenol“ – Versionsunterschied
| [gesichtete Version] | [gesichtete Version] |
K ⚙️ Bot: Quelltextbereinigung, prüfe und aktualisiere Vorlagen-Einbindungen |
HSDB aktualisiert |
||
| Zeile 42: | Zeile 42: | ||
}} |
}} |
||
'''Triadimenol''' ist ein Gemisch von vier [[Isomer|isomeren]] [[ |
'''Triadimenol''' ist ein Gemisch von vier [[Isomer|isomeren]] [[Chemische Verbindung|chemischen Verbindungen]] aus der Gruppe der [[Conazole]] bzw. [[Triazole]]. |
||
== Gewinnung und Darstellung == |
== Gewinnung und Darstellung == |
||
Triadimenol kann durch eine [[Meerwein-Ponndorf-Verley-Reduktion]] von [[Triadimefon]] mit [[Aluminiumisopropanolat]] hergestellt werden.<ref name="HSDB">{{HSDB| |
Triadimenol kann durch eine [[Meerwein-Ponndorf-Verley-Reduktion]] von [[Triadimefon]] mit [[Aluminiumisopropanolat]] hergestellt werden.<ref name="HSDB">{{HSDB|ID=7733|Name=Triadimenol|Abruf=2013-04-12}}</ref> |
||
[[Datei:Triadimenol synthesis V2.svg| |
[[Datei:Triadimenol synthesis V2.svg|rahmenlos|hochkant=2.0|zentriert|Synthese von Triadimenol]] |
||
== Eigenschaften == |
== Eigenschaften == |
||
Triadimenol ist ein brennbarer weißer bis grauer Feststoff mit phenolartigem Geruch, der praktisch unlöslich in Wasser ist. Es hat einen [[Flammpunkt]] von 100 °C und zersetzt sich bei Erhitzung über 150 °C.<ref name="GESTIS" /> Triadimenol ist stabil gegenüber [[Hydrolyse]] bei [[pH-Wert]]en von 4, 7 and 9 und unterliegt in geringem Maße der [[Photolyse]].<ref name="FAO">FAO: [http://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/Specs/Triadimenol_2011.pdf FAO SPECIFICATIONS AND EVALUATIONS FOR AGRICULTURAL PESTICIDES - Triadimenol] (PDF; 524 kB)</ref> Die oxidative Zersetzung unter Luft startet beim Erhitzen bei Temperaturen oberhalb von 200 °C. Hauptprodukte der Zersetzung sind [[4-Chlorphenol]], [[4-Chlorbenzaldehyd]], 5-Chlor-2-hydroxybenzaldehyd, 5-Chlorbenzofuran, 4-Chlor-4-ethoxybenzol, 1-Ethyl-1''H''-pyrrol-2,5-dion und 2,2-Dimethylpropionsäure-4-chlorphenylester.<ref name="Borucka1">Monika Borucka, Maciej Celiński: ''Thermal Degradation and Combustion Behavior of Antifungal Pesticides: Triadimenol and Tebuconazole'' in [[Chem. Eng. Trans.]] 77 (2019) 139–144, |
Triadimenol ist ein brennbarer weißer bis grauer Feststoff mit phenolartigem Geruch, der praktisch unlöslich in Wasser ist. Es hat einen [[Flammpunkt]] von 100 °C und zersetzt sich bei Erhitzung über 150 °C.<ref name="GESTIS" /> Triadimenol ist stabil gegenüber [[Hydrolyse]] bei [[pH-Wert]]en von 4, 7 and 9 und unterliegt in geringem Maße der [[Photolyse]].<ref name="FAO">FAO: [http://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/Specs/Triadimenol_2011.pdf FAO SPECIFICATIONS AND EVALUATIONS FOR AGRICULTURAL PESTICIDES - Triadimenol] (PDF; 524 kB)</ref> Die oxidative Zersetzung unter Luft startet beim Erhitzen bei Temperaturen oberhalb von 200 °C. Hauptprodukte der Zersetzung sind [[4-Chlorphenol]], [[4-Chlorbenzaldehyd]], 5-Chlor-2-hydroxybenzaldehyd, 5-Chlorbenzofuran, 4-Chlor-4-ethoxybenzol, 1-Ethyl-1''H''-pyrrol-2,5-dion und 2,2-Dimethylpropionsäure-4-chlorphenylester.<ref name="Borucka1">Monika Borucka, Maciej Celiński: ''Thermal Degradation and Combustion Behavior of Antifungal Pesticides: Triadimenol and Tebuconazole'' in [[Chem. Eng. Trans.]] 77 (2019) 139–144, [[doi:10.3303/CET1977024]], [https://www.aidic.it/cet/19/77/024.pdf Open Access].</ref><ref name="Borucka2">Monika Borucka, Maciej Celinski, Kamila Sałasinska, Agnieszka Gajek: ''Identification of volatile and semi-volatile organic compounds emitted during thermal degradation and combustion of triadimenol'' in [[J. Therm. Anal. Calorim.]] 139 (2020) 1493–1506, [[doi:10.1007/s10973-019-08531-y]] (Open Access).</ref> |
||
== Stereochemie == |
== Stereochemie == |
||
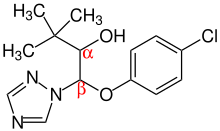
Triadimenol enthält zwei [[Stereozentrum|Stereozentren]] in α-Position und β-Position: |
Triadimenol enthält zwei [[Stereozentrum|Stereozentren]] in α-Position und β-Position: |
||
[[Datei:Triadimenol alpha,beta-Position structural forrmula V1.svg|rahmenlos|zentriert|Triadimenol mit eigens markierter alpha- und beta-Position]] |
[[Datei:Triadimenol alpha,beta-Position structural forrmula V1.svg|rahmenlos|hochkant=1.0|zentriert|Triadimenol mit eigens markierter alpha- und beta-Position]] |
||
Dami gibt es insgesamt vier [[Stereoisomere]]. Das technische Produkt besteht zu 70 bis 85 % aus dem racemischen Diastereoisomer A [(α''R'',β''S'') + (α''S'',β''R'')], das Diastereoisomer B [(α''R'',β''R'') + (α''S'',β''S'')] liegt hingegen zwischen 15 und 30 % vor:<ref name="PSM" |
Dami gibt es insgesamt vier [[Stereoisomere]]. Das technische Produkt besteht zu 70 bis 85 % aus dem racemischen Diastereoisomer A [(α''R'',β''S'') + (α''S'',β''R'')], das Diastereoisomer B [(α''R'',β''R'') + (α''S'',β''S'')] liegt hingegen zwischen 15 und 30 % vor:<ref name="PSM" /> |
||
{| class="wikitable" style="text-align:center" |
{| class="wikitable" style="text-align:center" |
||
| Zeile 63: | Zeile 63: | ||
! colspan="2"| Stereoisomere von Triadimenol |
! colspan="2"| Stereoisomere von Triadimenol |
||
|- |
|- |
||
| [[Datei:(R,S)-Triadimenol structural formula V2.svg| |
| [[Datei:(R,S)-Triadimenol structural formula V2.svg|200px]]<br /><small>(α''R'',β''S'')-Stereoisomer</small> |
||
| [[Datei:(S,R)-Triadimenol structural forrmula V2.svg| |
| [[Datei:(S,R)-Triadimenol structural forrmula V2.svg|200px]]<br /><small>(α''S'',β''R'')-Stereoisomer</small> |
||
|- |
|- |
||
| [[Datei:(R,R)-Triadimenol structural formula V2.svg| |
| [[Datei:(R,R)-Triadimenol structural formula V2.svg|200px]]<br /><small>(α''R'',β''R'')-Stereoisomer</small> |
||
| [[Datei:(S,S)-Triadimenol structural forrmula V2.svg| |
| [[Datei:(S,S)-Triadimenol structural forrmula V2.svg|200px]]<br /><small>(α''S'',β''S'')-Stereoisomer</small> |
||
|} |
|} |
||
== Verwendung == |
== Verwendung == |
||
Triadimenol ist ein systemisches [[Fungizid]] mit breitem Wirkungsspektrum. Es hemmt die [[Ergosterol]]- und [[Gibberellin]]-[[Biosynthese]] und damit die Rate der Zellteilung.<ref name="FAO" /> Die Verbindung wurde 1978 auf den Markt gebracht.<ref name="Horst Börner, Klaus Schlüter">{{Literatur | |
Triadimenol ist ein systemisches [[Fungizid]] mit breitem Wirkungsspektrum. Es hemmt die [[Ergosterol]]- und [[Gibberellin]]-[[Biosynthese]] und damit die Rate der Zellteilung.<ref name="FAO" /> Die Verbindung wurde 1978 auf den Markt gebracht.<ref name="Horst Börner, Klaus Schlüter">{{Literatur |Autor=Horst Börner, Klaus Schlüter |Titel=Pflanzenkrankheiten und Pflanzenschutz |Verlag=Springer |Datum=2009 |ISBN=3-540-49068-X |Seiten=496 |Online={{Google Buch | BuchID = ZPKKx0wPHIAC | Seite = 496 }}}}</ref> |
||
== Zulassung == |
== Zulassung == |
||
In der Europäischen Union kann Triadimenol bei [[Pflanzenschutzmittel]]n seit September 2009 für Anwendungen als Fungizid verwendet werden.<ref>{{EUR-Lex-Rechtsakt|reihe=L|jahr=2008|amtsblattnummer=344|anfangsseite=78|endseite=88|format=PDF|titel=Richtlinie 2008/125/EG der Kommission vom 19. Dezember 2008}} zur Änderung der Richtlinie 91/414/EWG des Rates zwecks Aufnahme von Aluminiumphosphid, Calciumphosphid, Magnesiumphosphid, Cymoxanil, Dodemorph, 2,5-Dichlorbenzoesäuremethylester, Metamitron, Sulcotrion, Tebuconazol und Triadimenol als Wirkstoffe.</ref> Da kein Antrag auf Erneuerung der Wirkstoffgenehmigung gestellt wurde, endete die EU-Genehmigung für Triadimenol als Wirkstoff in Pflanzenschutzmitteln, gemäß Durchführungsverordnung (EU) Nr. 540/2011, am 31. August 2019 durch Zeitablauf. In Deutschland gilt gemäß [[Pflanzenschutzgesetz]] noch eine Abverkaufsfrist bis zum 29. Februar 2020 und eine Aufbrauchfrist bis zum 28. Februar 2021.<ref>{{Internetquelle |url=https://www.bvl.bund.de/DE/04_Pflanzenschutzmittel/06_Fachmeldungen/2019/2019_05_05_Fa_Widerruf_Triadimenol.html |titel=Widerruf der Zulassung von Pflanzenschutzmitteln mit dem Wirkstoff Triadimenol zum 31. August 2019 |werk=[[Bundesamt für Verbraucherschutz und Lebensmittelsicherheit|bvl.bund.de]] |
In der Europäischen Union kann Triadimenol bei [[Pflanzenschutzmittel]]n seit September 2009 für Anwendungen als Fungizid verwendet werden.<ref>{{EUR-Lex-Rechtsakt|reihe=L|jahr=2008|amtsblattnummer=344|anfangsseite=78|endseite=88|format=PDF|titel=Richtlinie 2008/125/EG der Kommission vom 19. Dezember 2008}} zur Änderung der Richtlinie 91/414/EWG des Rates zwecks Aufnahme von Aluminiumphosphid, Calciumphosphid, Magnesiumphosphid, Cymoxanil, Dodemorph, 2,5-Dichlorbenzoesäuremethylester, Metamitron, Sulcotrion, Tebuconazol und Triadimenol als Wirkstoffe.</ref> Da kein Antrag auf Erneuerung der Wirkstoffgenehmigung gestellt wurde, endete die EU-Genehmigung für Triadimenol als Wirkstoff in Pflanzenschutzmitteln, gemäß Durchführungsverordnung (EU) Nr. 540/2011, am 31. August 2019 durch Zeitablauf. In Deutschland gilt gemäß [[Pflanzenschutzgesetz]] noch eine Abverkaufsfrist bis zum 29. Februar 2020 und eine Aufbrauchfrist bis zum 28. Februar 2021.<ref>{{Internetquelle |autor=Bundesamt für Verbraucherschutz und Lebensmittelsicherheit |url=https://www.bvl.bund.de/DE/04_Pflanzenschutzmittel/06_Fachmeldungen/2019/2019_05_05_Fa_Widerruf_Triadimenol.html |titel=Widerruf der Zulassung von Pflanzenschutzmitteln mit dem Wirkstoff Triadimenol zum 31. August 2019 |werk=[[Bundesamt für Verbraucherschutz und Lebensmittelsicherheit|bvl.bund.de]] |datum=2019-05-08 |abruf=2019-05-10}}</ref> In der Schweiz endet die Aufbrauchsfrist für das einzig mit diesem Wirkstoff erhältliche Pestizid am 31. Oktober 2020. In zehn EU-Mitgliedstaaten bleibt Triadimenol unter gewissen Auflagen zugelassen.<ref name="PSM">{{PSM-Verz|EU=Triadimenol |CH=Triadimenol |D=DB |Abruf=2020-04-25}}</ref> Zudem wird der von [[Bayer AG|Bayer]] hergestellte Wirkstoff auch auf dem brasilianischen und südafrikanischen Markt vertrieben.<ref>{{Internetquelle |autor=Benjamin Luig, Fran Paula de Castro und Alan Tygel (beide Campanha Permanente Contra os Agrotóxicos e Pela Vida), Lena Luig (INKOTA-netzwerk), Simphiwe Dada (Khanyisa), Sarah Schneider (MISEREOR) und Jan Urhahn (Rosa-Luxemburg-Stiftung) |url=https://www.rosalux.de/fileadmin/rls_uploads/pdfs/Studien/Studie_Gefaehrliche_Pestizide_20200420.pdf |titel=Gefährliche Pestizide |titelerg=von Bayer und BASF – ein globales Geschäft mit Doppelstandards |hrsg=[[Rosa-Luxemburg-Stiftung]], [[INKOTA-netzwerk]], [[Bischöfliches Hilfswerk Misereor]] u. a. |datum=2020-04 |format=PDF; 2,4 MB |abruf=2020-04-25}}</ref> |
||
== Einzelnachweise == |
== Einzelnachweise == |
||
Version vom 5. Juni 2021, 09:48 Uhr
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Triadimenol | ||||||||||||||||||
| Andere Namen |
α-tert-Butyl-β-(4-chlorphenoxy)-1H-1,2,4-triazol-1-ethanol | ||||||||||||||||||
| Summenformel | C14H18ClN3O2 | ||||||||||||||||||
| Kurzbeschreibung |
weißer bis grauer Feststoff mit phenolartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 295,77 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Triadimenol ist ein Gemisch von vier isomeren chemischen Verbindungen aus der Gruppe der Conazole bzw. Triazole.
Gewinnung und Darstellung
Triadimenol kann durch eine Meerwein-Ponndorf-Verley-Reduktion von Triadimefon mit Aluminiumisopropanolat hergestellt werden.[5]

Eigenschaften
Triadimenol ist ein brennbarer weißer bis grauer Feststoff mit phenolartigem Geruch, der praktisch unlöslich in Wasser ist. Es hat einen Flammpunkt von 100 °C und zersetzt sich bei Erhitzung über 150 °C.[1] Triadimenol ist stabil gegenüber Hydrolyse bei pH-Werten von 4, 7 and 9 und unterliegt in geringem Maße der Photolyse.[2] Die oxidative Zersetzung unter Luft startet beim Erhitzen bei Temperaturen oberhalb von 200 °C. Hauptprodukte der Zersetzung sind 4-Chlorphenol, 4-Chlorbenzaldehyd, 5-Chlor-2-hydroxybenzaldehyd, 5-Chlorbenzofuran, 4-Chlor-4-ethoxybenzol, 1-Ethyl-1H-pyrrol-2,5-dion und 2,2-Dimethylpropionsäure-4-chlorphenylester.[6][7]
Stereochemie
Triadimenol enthält zwei Stereozentren in α-Position und β-Position:
Dami gibt es insgesamt vier Stereoisomere. Das technische Produkt besteht zu 70 bis 85 % aus dem racemischen Diastereoisomer A [(αR,βS) + (αS,βR)], das Diastereoisomer B [(αR,βR) + (αS,βS)] liegt hingegen zwischen 15 und 30 % vor:[8]
| Stereoisomere von Triadimenol | |
|---|---|
 (αR,βS)-Stereoisomer |
 (αS,βR)-Stereoisomer |
 (αR,βR)-Stereoisomer |
 (αS,βS)-Stereoisomer |
Verwendung
Triadimenol ist ein systemisches Fungizid mit breitem Wirkungsspektrum. Es hemmt die Ergosterol- und Gibberellin-Biosynthese und damit die Rate der Zellteilung.[2] Die Verbindung wurde 1978 auf den Markt gebracht.[9]
Zulassung
In der Europäischen Union kann Triadimenol bei Pflanzenschutzmitteln seit September 2009 für Anwendungen als Fungizid verwendet werden.[10] Da kein Antrag auf Erneuerung der Wirkstoffgenehmigung gestellt wurde, endete die EU-Genehmigung für Triadimenol als Wirkstoff in Pflanzenschutzmitteln, gemäß Durchführungsverordnung (EU) Nr. 540/2011, am 31. August 2019 durch Zeitablauf. In Deutschland gilt gemäß Pflanzenschutzgesetz noch eine Abverkaufsfrist bis zum 29. Februar 2020 und eine Aufbrauchfrist bis zum 28. Februar 2021.[11] In der Schweiz endet die Aufbrauchsfrist für das einzig mit diesem Wirkstoff erhältliche Pestizid am 31. Oktober 2020. In zehn EU-Mitgliedstaaten bleibt Triadimenol unter gewissen Auflagen zugelassen.[8] Zudem wird der von Bayer hergestellte Wirkstoff auch auf dem brasilianischen und südafrikanischen Markt vertrieben.[12]
Einzelnachweise
- ↑ a b c d e f g h i j k l Eintrag zu Triadimenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 31. Dezember 2019. (JavaScript erforderlich)
- ↑ a b c FAO: FAO SPECIFICATIONS AND EVALUATIONS FOR AGRICULTURAL PESTICIDES - Triadimenol (PDF; 524 kB)
- ↑ Eintrag zu α-tert-butyl-β-(4-chlorophenoxy)-1H-1,2,4-triazole-1-ethanol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 31. Dezember 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Triadimenol bei Sigma-Aldrich, abgerufen am 31. Dezember 2019 (PDF).
- ↑ Eintrag zu Triadimenol in der Hazardous Substances Data Bank (via PubChem), abgerufen am 12. April 2013.
- ↑ Monika Borucka, Maciej Celiński: Thermal Degradation and Combustion Behavior of Antifungal Pesticides: Triadimenol and Tebuconazole in Chem. Eng. Trans. 77 (2019) 139–144, doi:10.3303/CET1977024, Open Access.
- ↑ Monika Borucka, Maciej Celinski, Kamila Sałasinska, Agnieszka Gajek: Identification of volatile and semi-volatile organic compounds emitted during thermal degradation and combustion of triadimenol in J. Therm. Anal. Calorim. 139 (2020) 1493–1506, doi:10.1007/s10973-019-08531-y (Open Access).
- ↑ a b Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Triadimenol in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz und Deutschlands, abgerufen am 25. April 2020. Nicht definierte Angabe im Parameter
CH= - ↑ Horst Börner, Klaus Schlüter: Pflanzenkrankheiten und Pflanzenschutz. Springer, 2009, ISBN 3-540-49068-X, S. 496 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Richtlinie 2008/125/EG der Kommission vom 19. Dezember 2008 (PDF) zur Änderung der Richtlinie 91/414/EWG des Rates zwecks Aufnahme von Aluminiumphosphid, Calciumphosphid, Magnesiumphosphid, Cymoxanil, Dodemorph, 2,5-Dichlorbenzoesäuremethylester, Metamitron, Sulcotrion, Tebuconazol und Triadimenol als Wirkstoffe.
- ↑ Bundesamt für Verbraucherschutz und Lebensmittelsicherheit: Widerruf der Zulassung von Pflanzenschutzmitteln mit dem Wirkstoff Triadimenol zum 31. August 2019. In: bvl.bund.de. 8. Mai 2019, abgerufen am 10. Mai 2019.
- ↑ Benjamin Luig, Fran Paula de Castro und Alan Tygel (beide Campanha Permanente Contra os Agrotóxicos e Pela Vida), Lena Luig (INKOTA-netzwerk), Simphiwe Dada (Khanyisa), Sarah Schneider (MISEREOR) und Jan Urhahn (Rosa-Luxemburg-Stiftung): Gefährliche Pestizide. (PDF; 2,4 MB) von Bayer und BASF – ein globales Geschäft mit Doppelstandards. Rosa-Luxemburg-Stiftung, INKOTA-netzwerk, Bischöfliches Hilfswerk Misereor u. a., April 2020, abgerufen am 25. April 2020.


