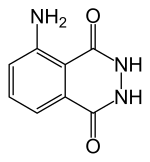
Luminol
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Luminol | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C8H7N3O2 | |||||||||
| Kurzbeschreibung |
blaßgelbes kristallines Pulver[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 177,16 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | ||||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Luminol ist eine gelblich bis grün schimmernde, in Wasser unlösliche feste chemische Verbindung, die sich formal vom Anilin, der Phthalsäure und Hydrazin ableitet.
Gewinnung und Herstellung
Die Herstellung von Luminol erfolgt über die Nitrierung von Phthalsäure zu 3-Nitrophthalsäure, deren Umsetzung mit Hydrazin zu 3-Nitrophthalsäurehydrazid und nachfolgender Reduktion mit Natriumdithionit zum Luminol.
Alternativ ist die Synthese von 3-Nitrophthalhydrazid aus 3-Nitrophthalsäureanhydrid möglich, welche bessere Ausbeuten liefert.[6]
Verwendung
Kriminalistik

Luminol wird in der Kriminalistik zur Spurensuche verwendet, selbst geringste Mengen von Blut lassen sich hiermit nachweisen. Der Nachweis beruht darauf, dass Luminol mit Oxidationsmitteln (meist Wasserstoffperoxid) unter Emission von bläulichem Licht (Chemolumineszenz) reagiert. Diese Reaktion verläuft nur bei Anwesenheit eines Katalysators (hier komplex gebundenes Fe2+ oder Fe3+) ausreichend schnell, d. h. in der Praxis ist bei der Abwesenheit von Katalysatoren keine Reaktion bzw. keine Chemolumineszenz zu beobachten.
Zur Spurensuche werden zwei Lösungen hergestellt: Eine Lösung von Luminol in Natronlauge und eine verdünnte Wasserstoffperoxid-Lösung. Diese werden kurz vor der Anwendung zusammengegeben und die zu untersuchenden Flächen eingesprüht. Befinden sich darauf Blutspuren, so katalysiert der Blutfarbstoff Hämoglobin (enthält Häm, einen Eisenkomplex) die oben beschriebene Reaktion. Es kommt also zu einer bläulichen Chemolumineszenz. Der Test ist empfindlich genug, um winzige Blutmengen im Urin nachzuweisen, wodurch Urinflecken ebenfalls „positiv“ erscheinen. Allerdings wird die Reaktion auch durch Kupferionen katalysiert, welche diesen Test somit stören.
Durch Zugabe von weiteren Substanzen kann die Empfindlichkeit variiert werden: In einer Testreihe konnte nachgewiesen werden, dass Wirkstoffe in dem Geschirrspülmittel Fit die Fluoreszenz intensivieren, zugleich aber auch verkürzen.[7] Ursache hierfür könnten Detergenzien im Reinigungsmittel sein, die die Plasmamembranen der Erythrozyten durchlässiger machen, wodurch das Luminol schneller mit dem Fe2+ in Kontakt kommt.[8]
Biochemische und medizinische Analytik
Eine weitaus wichtigere Anwendung findet die Luminol-Chemolumineszenz in der biochemischen und medizinischen Analytik. Hier werden z. B. sogenannte Reaktive Sauerstoffspezies (ROS) in Geweben, Extrakten und Körperflüssigkeiten direkt durch die Intensität der Luminol-Chemolumineszenz bestimmt. Eine weitere wichtige Analysenmethode beruht darauf, dass auch Peroxidasen in der Lage sind, die Luminol-Reaktion zu katalysieren. Auf diesem Prinzip werden zahlreiche Immunoassays aufgebaut, mit denen sich extrem geringe Mengen an Toxinen, Krankheitserregern, Peptiden und Proteinen nachweisen lassen.[9] Die wichtigste hierfür verwendete Peroxidase ist die Meerrettichperoxidase (HRP, horseradish peroxidase). Die katalytische Wirkung der Meerrettichperoxidase kann man selbst testen, indem man einige Tropfen einer alkalischen Luminol/Wasserstoffperoxid Lösung auf ein Stück frischen Meerrettich tropft.
Chemolumineszenzreaktion

Bei der Chemolumineszenz-Reaktion handelt es sich bei Luminol als Ausgangsstoff um eine Dicarbonylverbindung, ein so genanntes 1,4-Dion.
Der Stoff wird zunächst in Natronlauge gelöst, wobei Luminol als Säure unter H+-Abspaltung mit den Hydroxidionen der Natronlauge reagiert. Bei dieser Reaktion handelt es sich um eine reversible Gleichgewichtsreaktion.
Die entstandenen Dianionen werden durch Mesomerie stabilisiert.
Die eigentliche Reaktion beginnt mit der Oxidation der Dianionen durch Wasserstoffperoxid oder ein anderes Oxidationsmittel. Dabei entsteht neben molekularem Stickstoff ein Phthalat, das 3-Aminophthalat-Dianion, als instabiles Intermediat im angeregten Triplett-Zustand (T1). Der Triplett-Zustand liegt aufgrund von zwei Elektronen mit identischem Spin in einem Orbital eines Sauerstoffatoms vor (2S+1=3 bei S=1=2*1/2, siehe Multiplizität). Durch einen strahlungslosen Übergang geht das Molekül mit einem Spin-Flip in einen isoenergetisch angeregten Singulett-Zustand (S1) über.
Das energiereiche oxidierte Luminol-Molekül dient bei dieser Chemolumineszenz gleichzeitig als Sensibilisator. Durch den Übergang des Elektrons aus dem höher angeregten Singulettzustand in den Singulettgrundzustand (S0) wird ein Photon im blauen Bereich des Lichtspektrums emittiert.
Einzelnachweise
- ↑ Arnold Willmes, Taschenbuch Chemische Substanzen, Harri Deutsch, Frankfurt (M.), 2007.
- ↑ a b Vorlage:Acros
- ↑ a b c Mary Eagleson: Concise Encyclopedia Chemistry. Walter de Gruyter, 1994. ISBN 9783110114515. S. 607.
- ↑ a b Datenblatt Luminol bei Sigma-Aldrich (PDF).
- ↑ Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar).
- ↑ H. D. K. Drew, F. H. Pearman: Chemiluminescent organic compounds. Part II. The effect of substituents on the closure of phthalhydrazides to 5- and 6-membered rings, J. Chem. Soc., 1937, 26-33.
- ↑ Katrin Heuser, Martin Oehmen, Nadine Kühner und Mark Benecke: Wirkung des Spülmittels „Fit“ auf die Luminol-Fluoreszenz. In: Archiv für Kriminologie. Nr. 217, 2006, S. 137–145 (Online).
- ↑ Katrin Heuser, Martin Oehmen, Nadine Kühner und Mark Benecke: Wirkung des Spülmittels "Fit" auf die Luminol-Fluoreszenz. In: Archiv für Kriminologie. Nr. 217, 2006, S. 144 (Online).
- ↑ Steffen Albrecht, Herbert Brandl, Thomas Zimmermann, Chemilumineszenz, Hüthig Verlag, Heidelberg 1996.

