Paraldehyd
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Strukturformel des Trimers von Acetaldehyd ohne Stereochemie | ||||||||||
| Allgemeines | ||||||||||
| Freiname | Paraldehyd | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C6H12O3 | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit süßlichem Geruch[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code | ||||||||||
| Wirkstoffklasse |
Sedativum, Hypnotikum | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 132,16 g·mol−1 | |||||||||
| Dichte |
0,99 g·cm−3(20 °C)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
124 °C[1] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit | ||||||||||
| Brechungsindex |
1,405 (20 °C)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Paraldehyd ist eine chemische Verbindung. Es ist das Trimer des Acetaldehyd. Es handelt sich um ein cyclisches Vollacetal. Entsprechend ist das Molekül instabil, schon gegenüber verdünnten Säuren.
Gewinnung und Darstellung
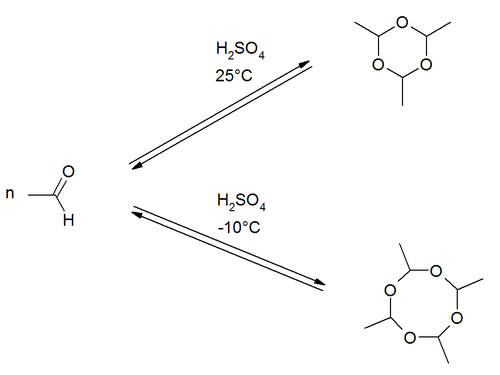
Paraldehyd entsteht durch Cyclisierung von drei Molekülen Acetaldehyd in Gegenwart von Schwefelsäure. Die Produktbildung der Cyclisierungsreaktion ist temperaturabhängig. Bei Raumtemperatur ist die Bildung des Trimers bevorzugt. Bei niedrigeren Temperaturen um −10 °C entsteht eher das Tetramere Metaldehyd.[6]
Eigenschaften
Paraldehyd ist eine klare und farblose Flüssigkeit, die mit typischen organischen Lösungsmitteln mischbar sowie in Wasser gut löslich ist. Die Löslichkeit in Wasser sinkt dabei mit steigender Temperatur.
Für die Molekülstruktur können zwei Stereoisomere formuliert werden, die als cis- (1) und trans-Paraldehyd (2) bekannt sind. Die beiden vorigen stehen im Gleichgewicht mit ihren jeweiligen Konformationsisomeren (4) bzw. (3), die allerdings aus sterischen Gründen, da sich hier die Methylgruppen gegenseitig behindern würden, sehr instabil sind.[7][8]
Sicherheitshinweise
Die Lagerung ist auf Grund der Instabilität schwierig. Man setzt ein Antioxidans zu und lagert fern von Licht und Wärme bzw. in Braunglasflaschen. Die angebrochenen Mengen sollten möglichst klein gehalten und schnell verbraucht werden.
Nachweis
- Der Aldehyd reagiert in der Tollensprobe mit einem Silberdiamminkomplex und bildet einen Silberspiegel aus elementarem Silber.
- In der Iodoformreaktion lässt sich die CH3-CO-Gruppe nachweisen.
Für beide Reaktionen ist eine saure Hydrolyse des Paraldehyds zu Acetaldehyd erforderlich.
Paraldehyd wird in Arzneibüchern monographiert.
Siehe auch
Einzelnachweise
- ↑ a b c d e f g Eintrag zu 2,4,6-Trimethyl-1,3,5-trioxan in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-410.
- ↑ a b Datenblatt Paraldehyde bei Sigma-Aldrich (PDF).
- ↑ Eintrag zu 2,4,6-trimethyl-1,3,5-trioxane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA) Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Paraldehyd bei Merck
- ↑ H.P. Latscha; U. Kazmaier; H.A. Klein: Chemie für Biologen, Springer Verlag 2005, ISBN 3-540-21161-6, S. 515.
- ↑ Kewley, R.: Microwave spectrum of paraldehyde. In: Canadian Journal of Chemistry. 48 (5), 1970, S. 852–855, doi:10.1139/v70-136.
- ↑ Carpenter, D.C., Brockway, L.O.: The Electron Diffration Study of Paraldehyde in J. Amer. Chem. Soc. 58 (1936), 1270–1273.