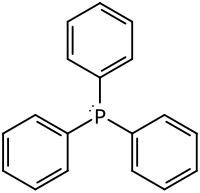
Triphenylphosphan
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Allgemeines | ||||||||||
| Name | Triphenylphosphan | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C18H15P | |||||||||
| Kurzbeschreibung |
farblose, monokline, tribolumineszierende Prismen[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 262,28 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt |
360 °C [2] | |||||||||
| Dampfdruck | ||||||||||
| Löslichkeit | ||||||||||
| Brechungsindex |
1,6358 (80 °C)[3] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| MAK |
DFG/Schweiz: 5 mg·m−3 (gemessen als einatembarer Staub)[2][4] | |||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Triphenylphosphan (auch: Triphenylphosphin, Triphenylphosphor, Phosphortriphenyl) ist ein Ligand (Komplexbildner) für die Herstellung von Metallkomplexen, die in der chemischen Synthese benötigt werden.
Eigenschaften
Triphenylphosphan bildet farblose, charakteristisch riechende Kristalle mit einem Schmelzpunkt um 80 °C und Siedepunkt von 360 °C, die nicht wasserlöslich sind, sich aber recht gut in organischen Lösungsmitteln lösen. Triphenylphosphan bildet leicht Übergangsmetallkomplexe, die sich in organischen Solventien (Lösungsmitteln) lösen und oft wertvoll für die Synthese sind. An der Luft bildet sich mit der Zeit Triphenylphosphanoxid.
Herstellung
Im Labormaßstab kann Triphenylphosphan durch Einwirkung von Phenylmagnesiumbromid[6] oder Phenyllithium auf Phosphortrichlorid dargestellt werden. Industriell erfolgt die Herstellung aus Phosphortrichlorid, Chlorbenzol und Natrium[7].
Verwendung
Triphenylphosphan ist Bestandteil des Wittig-Reagens, das großtechnisch für die Synthese von Vitamin A (Retinol) und Olefinen benötigt wird. Eine andere wichtige großtechnische Aufbaureaktion ist die moderne Variante der Hydroformylierung (auch: Oxosynthese), bei der ein Rhodiumkomplex des Triphenylphosphans eingesetzt wird, hierbei reagieren Alkene mit Kohlenstoffmonoxid und Wasserstoff zu wertvollen Aldehyden. Diese werden meist zu wichtigen Alkoholen weiterverarbeitet. Im Labormaßstab wird Triphenylphosphan zur Darstellung von Estern, Ethern, Amiden und Thioethern bei der Mitsunobu-Reaktion eingesetzt. Außerdem wird Triphenylphosphan im Labor als Bestandteil der Staudinger-Reaktion genutzt, bei der primäre Amine aus Aziden synthetisiert werden. Weiterhin spielt Triphenylphosphan als Ligand des Palladiumkatalysators eine Rolle, beispielsweise bei der Heck-Reaktion oder der Sonogashira-Kupplung (wie (PPh3)2PdCl2 oder (PPh3)Pd). Zuweilen wird dort auch das Arsenanalogon Triphenylarsin verwendet.
Struktur
-
Stäbchenmodell des Triphenylphosphan.
-
Kalottenmodell des Triphenylphosphan.
Einzelnachweise
- ↑ a b c Eintrag zu Triphenylphosphan. In: Römpp Online. Georg Thieme Verlag
- ↑ a b c d e f g h Eintrag zu Triphenylphosphan in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-512.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte
- ↑ Eintrag in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ J. Dodonow, H. Medox: Zur Kenntnis der Grignardschen Reaktion: Über die Darstellung von Tetraphenyl-phosphoniumsalzen. In: Berichte der Deutschen Chemischen Gesellschaft. Band 61, Nr. 5, 1928, S. 907 – 911, doi:10.1002/cber.19280610505.
- ↑ D. E. C. Corbridge: Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology. 5. Auflage. Elsevier, Amsterdam 1995, ISBN 0-444-89307-5.



