1,5-Dibrompentan
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||
| Name | 1,5-Dibrompentan | ||||||
| Andere Namen |
Pentamethylenbromid | ||||||
| Summenformel | C5H10Br2 | ||||||
| Kurzbeschreibung |
farbloser bis hellgelber Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 229,95 g·mol-1 | ||||||
| Aggregatzustand |
flüssig | ||||||
| Dichte |
1,70 g/cm3 (20 °C)[1] | ||||||
| Schmelzpunkt | |||||||
| Siedepunkt |
222 °C[1] | ||||||
| Löslichkeit |
sehr schlecht in Wasser[1] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
1,5-Dibrompentan ist eine chemische Verbindung aus der Gruppe der Halogenalkane. Sie ist aufgebaut aus dem Grundgerüst des Pentans mit zwei Bromsubstituenten an den beiden terminalen Positionen.
Darstellung
1,5-Dibrompentan kann durch die Umsetzung von 1,5-Pentandiol mit Bromwasserstoffsäure synthetisiert werden.[2]
Eine weitere Möglichkeit besteht in der Ringöffnung von Tetrahydropyran mit Bromwasserstoffsäure und Schwefelsäure.[3]
Eigenschaften
1,5-Dibrompentan ist eine bei Raumtemperatur flüssige, farblose Verbindung, die bei einer Temperatur von 222 °C siedet. Der Brechungsindex liegt bei einer Temperatur von 20 °C und einer Wellenlänge von 589 nm bei 1,5126.[4]
Verwendung
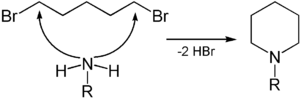
Durch Umsetzung von 1,5-Dibrompentan mit primären Aminen können N-alkylierte Derivate des Piperidins erhalten werden.[5][6]
Thian kann in guter Ausbeute durch die Reaktion von 1,5-Dibrompentan mit Natriumsulfid erhalten werden.[7]
- Reaktion von 1,5-Dibrompentan mit Natriumsulfid zu Thian und Natriumbromid.
Quellen
- ↑ a b c d e f Eintrag zu CAS-Nr. 111-24-0 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ A. Hochstetter: Über die Einwirkung von Wasser auf das Pentamethylenbromid, in: Monatsh. Chem. 1902, 23, 1071–1074. ISSN 0343-7329, doi:10.1007/BF01524939
- ↑ D. W. Andrus: Pentamethylen bromide, in: Org. Synth. 1943, 23, 67. CV3P0692.pdf (application/pdf-Objekt). www.orgsyn.org, abgerufen am 2. November 2008.
- ↑ R. Grzeskowiak, G. H. Jeffery and A. I. Vogel: Physical properties and chemical constitution. Part XXXI. Polymethylene dichlorides, dibromides, di-iodides, and dicyanides., in: J. Chem. Soc. 1960, 4728–4731. doi:10.1039/JR9600004728
- ↑ J. v. Braun: Die Aufspaltung cyclischer Basen durch Bromcyan., in: Chem. Ber. 1909, 42, 2035–2057. doi:10.1002/cber.19090420286
- ↑ J. Kenyon, H. Phillips, V. P. Pittman: Walden inversion reactions of d-β-butyl, d-β-octyl, and d-benzylmethylcarbinyl p-toluenesulphonates, in: J. Chem. Soc. 1935, 1072–1084. doi:10.1039/JR9350001663
- ↑ K. Nagasawa, A. Yoneta: Organosulfur Chemistry. II. Use of Dimethyl Sulfoxide – a Facile Synthesis of Cyclic Sulfides, in: Chem. Pharm. Bull 1985, 33, 5048–5052. ISSN 0009-2363, jnlpdf.php (application/pdf-Objekt). www.journalarchive.jst.go.jp, abgerufen am 2. November 2008.