2-Brompropansäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Brompropansäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H5BrO2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 152,98 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
| ||||||||||||||||||
| Dichte |
1,700 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
202–203 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
2,97 (18 °C)[5] | ||||||||||||||||||
| Löslichkeit |
löslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex |
1,4760 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Brompropionsäure ist eine chemische Verbindung aus der Gruppe der aliphatischen Carbonsäuren mit drei Kohlenstoffatomen, bei denen eines der an einem Kohlenstoffatom gebundenen Wasserstoffatome durch ein Bromatom ersetzt ist. Sie ist damit ein Derivat der Propionsäure.
Isomere[Bearbeiten | Quelltext bearbeiten]
2-Brompropionsäure ist optisch aktiv, da sie am zweiten C-Atom ein Chiralitätszentrum besitzt.
| Isomere von 2-Brompropansäure | ||
| Name | (2S)-2-Brompropansäure | (2R)-2-Brompropansäure |
| Andere Namen | (2S)-2-Brompropionsäure | (2R)-2-Brompropionsäure |
| Strukturformel | ||
| CAS-Nummer | 32644-15-8 | 10009-70-8 |
| 598-72-1 (Racemat) | ||
| EG-Nummer | 628-991-0 | 629-017-7 |
| 209-947-6 (Racemat) | ||
| ECHA-Infocard | 100.157.213 | 100.157.236 |
| 100.009.044 (Racemat) | ||
| PubChem | 642232 | 6992152 |
| 11729 (Racemat) | ||
| Wikidata | Q72511571 | Q100979758 |
| Q27291037 (Racemat) | ||
Gewinnung und Darstellung[Bearbeiten | Quelltext bearbeiten]
2-Brompropionsäure kann durch die Hell-Volhard-Zelinsky-Reaktion aus Propionsäure, Brom und rotem Phosphor dargestellt werden. Dabei wird das Racemat erhalten.
2-Brompropansäure entsteht auch durch Erhitzen von Milchsäure und gesättigter Bromwasserstoffsäure im geschlossenen Rohr.[6][7]
Eigenschaften[Bearbeiten | Quelltext bearbeiten]
2-Brompropionsäure ist ein gelber[1] Feststoff mit stechendem Geruch und niedrigem Schmelzpunkt, der löslich in Wasser ist.[2]
Die Säurestärke liegt wegen des −I-Effekts der Halogenatome über der der Stammverbindung Propionsäure.
Die Enantiomeren von 2-Brompropionsäure schmelzen bei −0,5 °C, wobei auch eine metastabile polymorphe Form mit einem Schmelzpunkt bei −10 °C beobachtet wurde.[3] Das Racemat liegt folgend aus dem hohen Schmelzpunkt bei 25,7 °C[3] als racemische Verbindung vor. Auch hier wurde eine metastabile polymorphe Form mit einem Schmelzpunkt bei −3,9 °C beobachtet.[3] Die racemische Mischung der beiden Enantiomeren sollte einen Schmelzpunkt um −20 °C besitzen.[3]
Bei Temperaturen über 300 °C zersetzt sich die Verbindung.[8]
Reaktionen[Bearbeiten | Quelltext bearbeiten]
2-Brompropansäure kann durch Erhitzen mit Kaliumhydroxid dehydrohalogeniert werden, es entsteht Acrylsäure.[9]
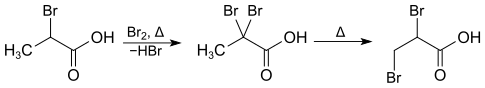
2-Brompropansäure kann durch Erhitzen mit elementarem Brom im geschlossenen Rohr in 2,2-Dibrompropansäure umgewandelt werden.[10], die sich beim weiteren Erhitzen in die 2,3-Dibrompropansäure umlagert.[11]
2-Brompropansäure kondensiert beim Erhitzen mit Silberpulver 2,3-Dimethylbernsteinsäure.[11]
Das in Wasser gelöste Kaliumsalz der 2-Brompropansäure zerfällt beim längeren Stehen in der Kälte in Kaliumbromid und Milchsäure.[11]
Im basischen Milieu hydrolysieren die Brompropansäuren, wie die 2-Brompropansäure, zu den entsprechenden Hydroxypropansäuren.[12]
Verwendung[Bearbeiten | Quelltext bearbeiten]
2-Brompropansäure wird als Zwischenprodukt zur Herstellung von Pharmazeutika und Pestiziden verwendet. Es wird als Alkylierungsmittel für Mercaptane und andere schwefelhaltige Verbindungen verwendet.[2] Aus 2-Brompropionsäure kann durch Fischer-Synthese Alanin hergestellt werden.
Sicherheitshinweise[Bearbeiten | Quelltext bearbeiten]
Bei starker Erhitzung sind explosionsfähige Gemische mit Luft möglich. Als kritisch ist ein Bereich ab ca. 15 Kelvin unterhalb des Flammpunktes von 100 °C zu bewerten.[1]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d Datenblatt 2-Brompropionsäure bei Merck, abgerufen am 15. August 2010.
- ↑ a b c d e f g h i j k l Datenblatt 2-Bromopropionic acid, 98% bei Alfa Aesar, abgerufen am 10. Mai 2022 (Seite nicht mehr abrufbar).
- ↑ a b c d e f L. Ramberg: Zur Kenntnis der α–Brompropionsäuren, in: Justus Liebigs Ann. Chem., 1909, Bd. 370, S. 234–239; doi:10.1002/jlac.19093700112.
- ↑ Datenblatt 2-Brompropionsäure bei www.chemicalland21.com, abgerufen am 15. November 2022.
- ↑ Eintrag zu 2-Bromopropionic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 15. November 2022. (Seite nicht mehr abrufbar)
- ↑ A. Kekulé: Über organische Säuren: Einwirkung von Bromwasserstoff auf mehratomige Säuren. In: Justus Liebigs Annalen der Chemie, 1864, Bd. 130 (1), S. 11–31. doi:10.1002/jlac.18641300103.
- ↑ Matthias Kehrer, Julian Mehler, Nicola Taccardi, Jens Nagengast, Julian Kadar, Dimitris Collias, Peter Dziezok, Peter Wasserscheid, Jakob Albert: Zwitterionic Hydrobromic Acid Carriers for the Synthesis of 2-Bromopropionic Acid from Lactide. In: ChemSusChem. Band 11, Nr. 6, 2018, S. 1063–1072, doi:10.1002/cssc.201702369.
- ↑ Gabriel Chuchani, Rosa M. Dominguez, Alexandra Rotinov: The kinetics and mechanisms of methyl 2-bromopropionate and 2-bromopropionic acid pyrolyses under maximum inhibition. In: International Journal of Chemical Kinetics. Band 23, Nr. 9, 1991, S. 779–783, doi:10.1002/kin.550230904.
- ↑ R. K. Bansal: A Textbook Of Organic Chemistry. New Age International, 2003, ISBN 81-224-1459-1, S. 541 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ O. Philippi, B. Tollens: Untersuchungen über die Allylgruppe. XIII. Ueber die α-Bibrompropionsäure. In: Justus Liebigs Annalen der Chemie, 1874, Bd. 171 (2), S. 313–333. doi:10.1002/jlac.18741710219
- ↑ a b c F. Beilstein: Handbuch der organischen Chemie, 3. Auflage, 1. Band. Verlag Leopold Voss, 1893. S. 480. Volltext
- ↑ E. Kowski: Ueber gebromte Propionsäuren. In: Justus Liebigs Annalen der Chemie, 1905, Bd. 342 (1), S. 124–138. doi:10.1002/jlac.19053420109