3-Phenylpropionitril
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
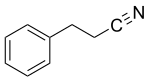
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 3-Phenylpropionitril | ||||||||||||||||||
| Andere Namen |
Phenylethylcyanid | ||||||||||||||||||
| Summenformel | C9H9N | ||||||||||||||||||
| Kurzbeschreibung |
hellgelbe Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 131,17 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,001 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
2 °C[1] | ||||||||||||||||||
| Siedepunkt |
113 °C (10 hPa)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
3-Phenylpropionitril ist eine aromatische chemische Verbindung aus der Gruppe der Nitrile.
Vorkommen[Bearbeiten | Quelltext bearbeiten]

3-Phenylpropionitril kommt als Abbauprodukt von Gluconasturtiin in verschiedenen Pflanzen vor.[2] Dazu gehören Brunnenkresse[2], Kohl[3][4], Brokkoli und Blumenkohl[4], Rübsen[5] und Steckrüben.[6] Die Bildung in Brunnenkresse wurde detailliert untersucht. Im Normalfall entsteht vor allem Phenylethylisothiocyanat und deutlich weniger 3-Phenylpropionitril (90 %:10 %). Wird zur Probe allerdings Fe2+ zugegeben, bildet sich deutlich mehr 3-Phenylpropionitril.[2]
Darstellung[Bearbeiten | Quelltext bearbeiten]
3-Phenylpropionitril kann zum Beispiel durch Oxidation von 3-Phenylpropan-1-ol mit elementarem Iod und wässriger Ammoniaklösung dargestellt werden. Statt Iod kann auch Diiodhydantoin als Oxidationsmittel verwendet werden.[7] Eine andere mögliche Darstellung besteht in der Umsetzung von 2-Phenylethylbromid mit Lithiumcyanid in Tetrahydrofuran.[8]
Einzelnachweise[Bearbeiten | Quelltext bearbeiten]
- ↑ a b c d e f g Datenblatt 3-Phenyl-propionitril bei Sigma-Aldrich, abgerufen am 12. Juni 2023 (PDF).
- ↑ a b c David J. Williams, Christa Critchley, Sharon Pun, Mridusmita Chaliha, Timothy J. O’Hare: Differing mechanisms of simple nitrile formation on glucosinolate degradation in Lepidium sativum and Nasturtium officinale seeds. In: Phytochemistry. Band 70, Nr. 11-12, Juli 2009, S. 1401–1409, doi:10.1016/j.phytochem.2009.07.035.
- ↑ Melvin E. Daxenbichler, Cecil H. Van Etten, Gayland F. Spencer: Glucosinolates and derived products in cruciferous vegetables. Identification of organic nitriles from cabbage. In: Journal of Agricultural and Food Chemistry. Band 25, Nr. 1, Januar 1977, S. 121–124, doi:10.1021/jf60209a053.
- ↑ a b Ron G. Buttery, Dan G. Guadagni, Louisa C. Ling, Richard M. Seifert, Werner Lipton: Additional volatile components of cabbage, broccoli, and cauliflower. In: Journal of Agricultural and Food Chemistry. Band 24, Nr. 4, Juli 1976, S. 829–832, doi:10.1021/jf60206a037.
- ↑ Seiji Hashimoto, Mitsuo Miyazawa, Hiromu Kameoka: Volatile Flavor Sulfur and Nitrogen Constituents of Brassica rapa L. In: Journal of Food Science. Band 47, Nr. 6, November 1982, S. 2084–2085, doi:10.1111/j.1365-2621.1982.tb12958.x.
- ↑ W. J. Mullin: Hydrolysis products from glucosinolates in rutabaga (Brassica napobrassica, Mill.)*. In: International Journal of Food Science & Technology. Band 15, Nr. 2, 28. Juni 2007, S. 163–168, doi:10.1111/j.1365-2621.1980.tb00928.x.
- ↑ Shinpei Iida, Hideo Togo: Direct oxidative conversion of alcohols and amines to nitriles with molecular iodine and DIH in aq NH3. In: Tetrahedron. Band 63, Nr. 34, August 2007, S. 8274–8281, doi:10.1016/j.tet.2007.05.106.
- ↑ Shinya Harusawa et al.: Non-Aqueous Cyanation of Halides using Lithium Cyanide. In: Tetrahedron Letters, Bd. 28, Nr. 36, 1987. S. 4189-4190. doi:10.1016/S0040-4039(00)95575-8.
